Новые публикации
Производные соединения талидомида приводят к гибели устойчивых раковых клеток
Последняя редакция: 02.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Исследование, проведенное Гёте-Университетом во Франкфурте, указывает на возможность того, что производные талидомида потенциально подходят для лечения рака. В 1950-х годах талидомид продавался как снотворное. Позже он приобрел печальную известность из-за вызывания серьезных пороков развития у плода на ранних стадиях беременности.
Также известно, что молекула помечает белки в клетке для их разрушения. В рамках текущего исследования ученые создали производные талидомида. Они смогли показать, что эти вещества влияют на разрушение белков, ответственных за выживание раковых клеток.
Возможно, ни одна другая молекула не имеет такого бурного прошлого, как талидомид. Он был основным компонентом лекарства, одобренного во многих странах в 1950-х годах как седативное и снотворное средство. Однако вскоре стало ясно, что беременные женщины, принимавшие талидомид, часто рожали детей с серьезными деформациями.
Однако в последние десятилетия медицина вновь возлагает на него большие надежды. Исследования показали, в том числе, что он ингибирует рост кровеносных сосудов и поэтому потенциально подходит для отсечения опухолей от их питательной среды. Затем он также оказался очень эффективным при лечении множественной миеломы, злокачественных опухолей в костном мозге.
"Теперь мы знаем, что талидомид можно назвать 'молекулярным клеем'", объясняет доктор Синлай Ченг из Института фармацевтической химии Гёте-Университета Франкфурт. "Это означает, что он способен захватывать два белка и соединять их."
Это особенно интересно, потому что один из этих белков является своего рода "маркировочной машиной": он прикрепляет к другому белку недвусмысленную метку "МУСОР".
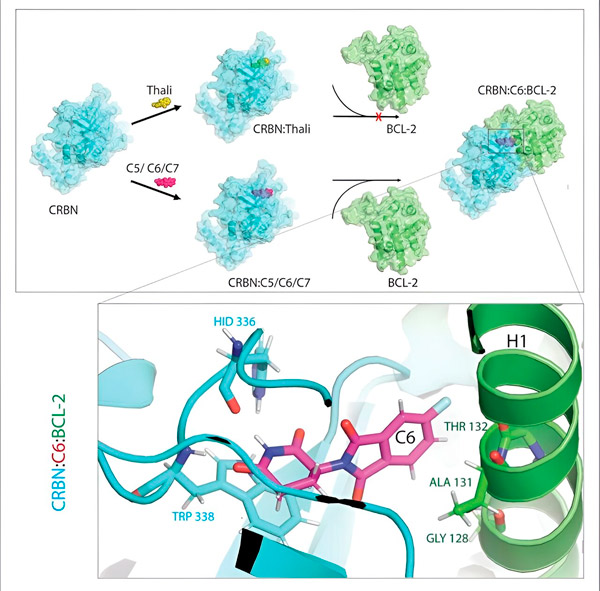
Производные талидомида C5, C6 и C7 изменяют CRBN — "маркирующую машину", так что она может связываться с BCL-2. Таким образом, молекула BCL-2 маркируется для деградации — возможная новая стратегия борьбы с раком. Автор: доктор Синлай Ченг.
Система утилизации отходов клетки распознает эту метку: она захватывает помеченную молекулу белка и измельчает ее. "Именно этот механизм объясняет различные эффекты талидомида", говорит Ченг. "В зависимости от того, какой белок помечен, это может привести к деформациям во время эмбрионального развития или к уничтожению злокачественных клеток."
Этот механизм открывает большие возможности для медицины, поскольку раковые клетки зависят от определенных белков для выживания. Если бы можно было систематически нацеливаться на них и измельчать, возможно, удалось бы вылечить болезнь. Проблема в том, что молекулярный клей довольно своеобразен.
Один из его связывающих партнеров всегда является маркировочной машиной клетки, или, научным языком, E3 лигазой, называемой CRBN. Только очень немногие из многих тысяч белков в организме могут быть вторым партнером — какие именно, зависит от клея.
"Поэтому мы создали ряд производных талидомида", говорит Ченг. "Затем мы исследовали, имеют ли они клеевые свойства и, если да, против каких белков они эффективны." Для этого исследователи добавили свои производные ко всем белкам в выращенной клеточной линии. Затем они наблюдали, какие из этих белков затем разлагались в присутствии CRBN.
"В процессе мы выявили три производных, способных пометить клеточный белок, который очень важен для разложения, BCL-2", объясняет Ченг. "BCL-2 предотвращает активацию программы самоуничтожения клеток, так что если его нет, клетки погибают."
Поэтому BCL-2 уже давно находится в центре внимания исследований рака. Даже уже существует лекарство для лечения лейкемии, называемое венетоклакс, которое снижает эффективность BCL-2 и таким образом заставляет мутированные клетки самоуничтожаться.
"Однако во многих раковых клетках сам BCL-2 мутирован. В результате венетоклакс больше не ингибирует белок", говорит Ченг. "Мы смогли показать, что наши производные также помечают эту мутированную форму для разложения. Кроме того, наши партнеры из Института биофизики Макса Планка смоделировали взаимодействие производных талидомида с BCL-2 на компьютере. Это показало, что производные связываются с совершенно другими участками, чем венетоклакс — результат, который мы позже также смогли подтвердить экспериментально."
Кроме того, исследователи тестировали свои вещества на плодовых мушках с раковыми клетками. Выживаемость мушек, обработанных таким образом, была значительно выше. Однако Ченг предостерегает от чрезмерных ожиданий, так как эти результаты все еще являются фундаментальными исследованиями. "Хотя они показывают, что модифицированные молекулы талидомида имеют большой терапевтический потенциал, мы пока не можем сказать, докажут ли они себя на практике в какой-то момент времени".
Результаты исследования опубликованы в журнале Cell Reports Physical Science.
