Новые публикации
Уточнение клеточных механизмов пародонтита с улучшенной моделью на животных
Последняя редакция: 02.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Исследователи из Токийского медицинского и стоматологического университета (TMDU) разработали методику, позволяющую детально анализировать развитие пародонтита с течением времени.
Пародонтальное заболевание, представленное пародонтитом, является основной причиной потери зубов и затрагивает почти каждого пятого взрослого человека в мире. В большинстве случаев это состояние возникает в результате воспалительной реакции на бактериальную инфекцию тканей вокруг зубов.
По мере ухудшения состояния десны начинают отступать, оголяя корни зубов и кость. Примечательно, что заболеваемость пародонтитом возрастает с возрастом, и с увеличением продолжительности жизни населения во всем мире важно иметь твердое понимание его основных причин и прогрессирования.
В исследовании, опубликованном в журнале Nature Communications, исследователи из TMDU нашли способ достижения этой цели, улучшив широко используемую модель для изучения пародонтита на животных.
Прямое изучение пародонтита у людей представляет сложности. В результате ученые часто прибегают к моделям на животных для доклинических исследований. Например, "модель пародонтита, индуцированного наложением лигатуры у мышей", с момента ее появления в 2012 году позволила исследователям изучать клеточные механизмы, лежащие в основе этого состояния.
Проще говоря, в этой модели пародонтальное заболевание искусственно вызывается наложением шелковых нитей на моляры мышей, что вызывает накопление зубного налета. Хотя этот метод удобен и эффективен, он не охватывает полную картину пародонтита.
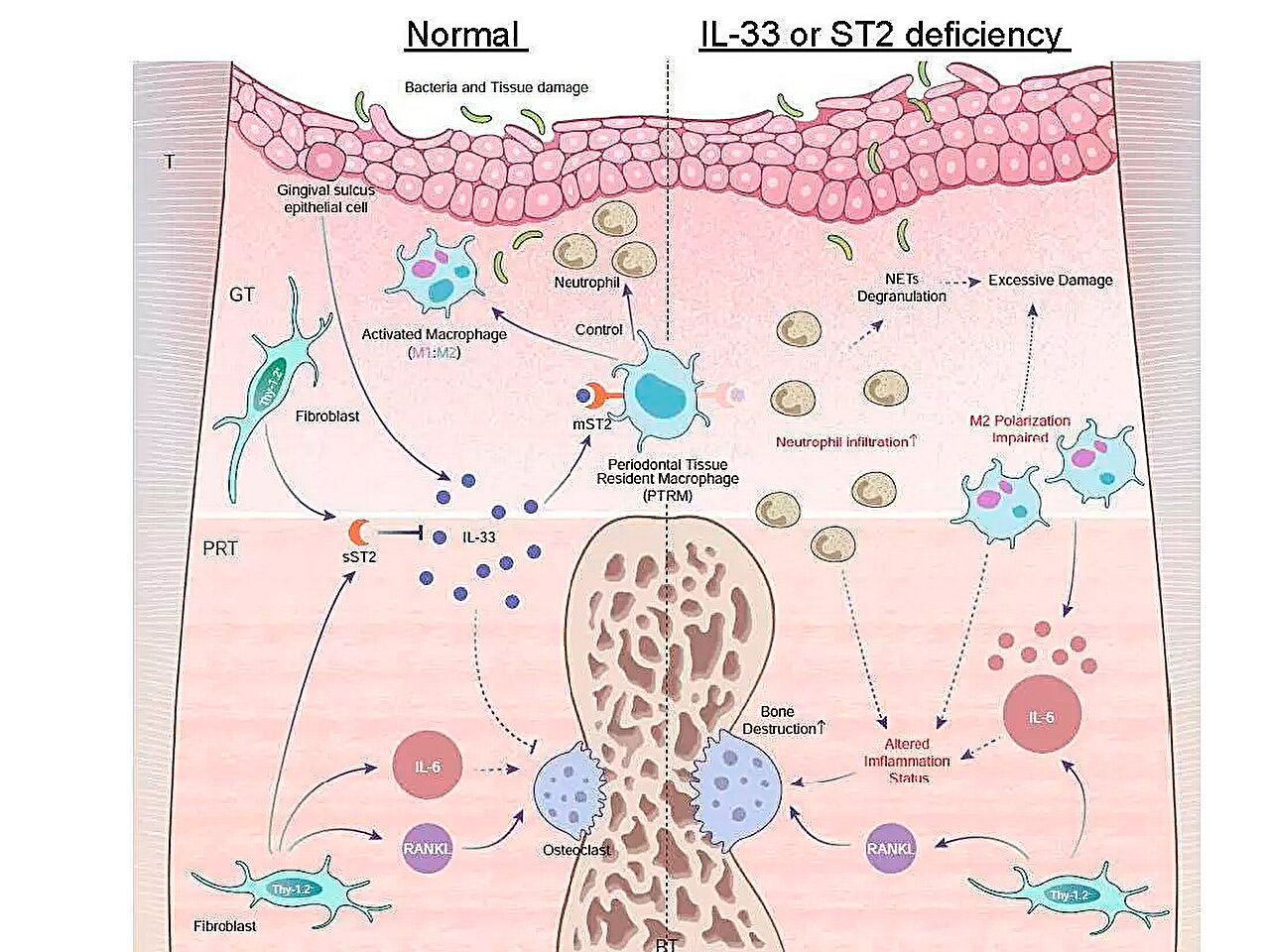
Схематическая иллюстрация профилей экспрессии воспалительных генов в ходе периодонтита и роли оси IL-33/ST2 в борьбе с острым воспалением. Источник: Токийский медицинский и стоматологический университет.
"Несмотря на то, что пародонтальная ткань состоит из десны, периодонтальной связки, альвеолярной кости и цемента, анализ обычно проводится исключительно на образцах десны из-за технических и количественных ограничений," отмечает ведущий автор исследования Анхао Лю. "Эта стратегия отбора проб ограничивает выводы, которые можно сделать из этих исследований, поэтому необходимы методы, позволяющие одновременно анализировать все компоненты ткани."
Для устранения этого ограничения исследовательская группа разработала модифицированную модель пародонтита, индуцированного лигатурой. Вместо классической одиночной лигатуры они использовали тройную лигатуру на верхнем левом моляре самцов мышей. Эта стратегия расширила зону потери костной массы без значительного разрушения кости вокруг второго моляра, увеличивая количество различных типов пародонтальной ткани.
"Мы изолировали три основных типа ткани и оценили выход РНК между двумя моделями. Результаты показали, что модель с тройной лигатурой эффективно увеличила выход, достигая в четыре раза большего количества нормальной перикорневой ткани и поддерживая высокоразрешающий анализ различных типов тканей," объясняет старший автор доктор Микихито Хаяши.
После подтверждения эффективности своей модифицированной модели исследователи приступили к изучению влияния пародонтита на экспрессию генов среди различных типов тканей с течением времени, сосредоточив внимание на генах, связанных с воспалением и дифференциацией остеокластов.
Одним из их основных выводов было то, что экспрессия гена Il1rl1 была значительно выше в перикорневой ткани через пять дней после наложения лигатуры. Этот ген кодирует белок ST2 в рецепторной и ловушечной изоформах, который связывается с цитокином под названием IL-33, участвующим в воспалительных и иммунорегуляторных процессах.
Для получения дальнейших сведений о роли этого гена команда вызвала пародонтит у генетически модифицированных мышей, у которых отсутствовали гены Il1rl1 или Il33. Эти мыши продемонстрировали ускоренное воспалительное разрушение костей, что подчеркивает защитную роль пути IL-33/ST2. Дальнейший анализ клеток, содержащих белок ST2 в его рецепторной форме, mST2, показал, что большинство из них происходят из макрофагов.
"Макрофаги обычно классифицируются на два основных типа, про-воспалительные и анти-воспалительные, в зависимости от их активации. Мы обнаружили, что клетки, экспрессирующие mST2, уникальны тем, что они одновременно экспрессируют некоторые маркеры обоих типов макрофагов," комментирует старший автор доктор Таканори Ивата. "Эти клетки присутствовали в перикорневой ткани до начала воспаления, поэтому мы назвали их 'макрофагами-резидентами пародонтальной ткани.'"
Вместе, результаты этого исследования демонстрируют мощь модифицированной модели животных для изучения пародонтита в более детальных масштабах, вплоть до биомолекулярного уровня.
"Мы предполагаем возможность существования нового молекулярного пути IL-33/ST2, регулирующего воспаление и разрушение костной ткани при пародонтальном заболевании, наряду со специфическими макрофагами в перикорневой ткани, что глубоко вовлечено в пародонтальную болезнь. Это, надеемся, приведет к разработке новых стратегий лечения и методов профилактики," заключает старший автор доктор Томоки Накашима.
