Новые публикации
Замкнутая система доставки лекарств может улучшить химиотерапию
Последняя редакция: 02.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Когда пациенты с раком проходят химиотерапию, дозы большинства препаратов рассчитываются на основе площади поверхности тела пациента. Этот показатель оценивается с помощью уравнения, в которое подставляются рост и вес пациента. Это уравнение было сформулировано в 1916 году на основе данных всего девяти пациентов.
Такой упрощенный подход к дозированию не учитывает другие факторы и может привести к тому, что пациенту назначат слишком большую или слишком малую дозу препарата. В результате некоторые пациенты могут испытывать излишнюю токсичность или недостаточную эффективность от получаемой химиотерапии.
Для повышения точности дозирования химиотерапии инженеры MIT разработали альтернативный подход, который позволяет персонализировать дозу для каждого пациента. Их система измеряет количество препарата в организме пациента, и эти данные вводятся в контроллер, который может соответственно корректировать скорость инфузии.
Этот подход может помочь компенсировать различия в фармакокинетике препаратов, вызванные составом тела, генетической предрасположенностью, токсичностью органов, вызванной химиотерапией, взаимодействием с другими принимаемыми лекарствами и пищей, а также циркадными колебаниями ферментов, ответственных за расщепление химиопрепаратов, утверждают исследователи.
"Осознавая достижения в понимании того, как метаболизируются препараты, и применяя инженерные инструменты для упрощения персонализированного дозирования, мы верим, что можем помочь трансформировать безопасность и эффективность многих препаратов," говорит Джованни Траверсо, доцент кафедры машиностроения в MIT, гастроэнтеролог в больнице Brigham and Women's Hospital и старший автор исследования.
Луис ДеРиддер, аспирант MIT, является ведущим автором статьи, опубликованной в журнале Med.
Непрерывный мониторинг
В этом исследовании ученые сосредоточились на препарате под названием 5-фторурацил, который используется для лечения колоректального рака и других видов рака. Препарат обычно вводится в течение 46-часового периода, и его дозировка определяется с использованием формулы, основанной на росте и весе пациента, что дает оценку площади поверхности тела.
Однако этот подход не учитывает различия в составе тела, которые могут повлиять на распространение препарата в организме, или генетические вариации, влияющие на его метаболизм. Эти различия могут привести к вредным побочным эффектам, если препарата слишком много. Если препарата недостаточно, он может не убить опухоль, как ожидалось.
"Люди с одинаковой площадью поверхности тела могут иметь очень разные рост и вес, разную мышечную массу или генетику, но пока рост и вес, подставленные в это уравнение, дают одну и ту же площадь поверхности тела, их доза идентична," говорит ДеРиддер, кандидат наук в программе медицинской инженерии и медицинской физики в рамках Программы в области медицинских наук и технологий Гарварда и MIT.
Другим фактором, который может изменять количество препарата в крови в любой момент времени, являются циркадные колебания фермента под названием дигидропиримидиндегидрогеназа (DPD), который расщепляет 5-фторурацил. Экспрессия DPD, как и многих других ферментов в организме, регулируется по циркадному ритму. Таким образом, деградация 5-ФУ DPD не является постоянной, а изменяется в зависимости от времени суток. Эти циркадные ритмы могут приводить к десятикратным колебаниям количества 5-фторурацила в крови пациента в течение инфузии.
"Используя площадь поверхности тела для расчета дозы химиотерапии, мы знаем, что два человека могут иметь совершенно разные токсичности от 5-фторурацила. У одного пациента могут быть циклы лечения с минимальной токсичностью, а затем цикл с ужасной токсичностью. Что-то изменилось в том, как этот пациент метаболизировал химиотерапию от одного цикла к другому. Наш устаревший метод дозирования не фиксирует эти изменения, и пациенты страдают в результате," говорит Дуглас Рубинсон, клинический онколог в Институте рака Dana-Farber и автор статьи.
Одним из способов попытаться компенсировать вариабельность в фармакокинетике химиотерапии является стратегия, называемая терапевтическим мониторингом лекарственных средств, при которой пациент сдает образец крови в конце одного цикла лечения. После анализа этого образца на концентрацию препарата дозировка может быть скорректирована, если это необходимо, в начале следующего цикла (обычно через две недели для 5-фторурацила).
Этот подход показал, что он приводит к лучшим результатам для пациентов, но не получил широкого применения для таких химиотерапий, как 5-фторурацил.
Исследователи MIT хотели разработать аналогичный тип мониторинга, но в автоматическом режиме, позволяющем персонализировать дозу препарата в реальном времени, что могло бы привести к лучшим результатам для пациентов.
В их системе с замкнутым контуром концентрации препарата могут непрерывно контролироваться, и эта информация используется для автоматической корректировки скорости инфузии химиотерапевтического препарата, чтобы поддерживать дозу в целевом диапазоне.
Такая система с замкнутым контуром позволяет персонализировать дозу препарата таким образом, чтобы учитывать циркадные ритмы изменения уровней ферментов, метаболизирующих препараты, а также любые изменения в фармакокинетике пациента с момента последнего лечения, такие как токсичность органов, вызванная химиотерапией.
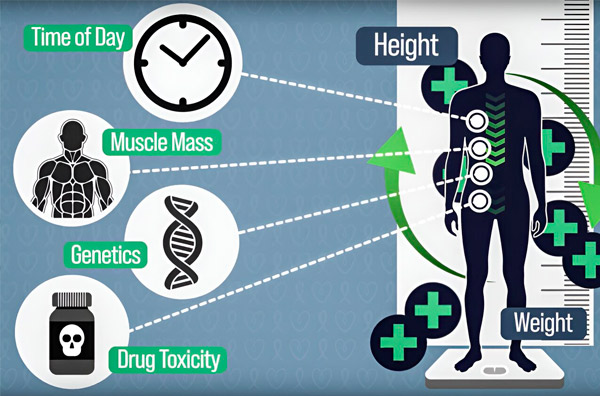
Чтобы сделать дозирование химиотерапии более точным, инженеры MIT разработали способ непрерывного измерения количества препарата в организме пациента во время многочасовой инфузии. Это поможет компенсировать различия, вызванные составом тела, генетикой, токсичностью препарата и циркадными колебаниями. Источник: предоставлено исследователями.
Новая система, разработанная исследователями, известная как CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor), использует коммерчески доступное оборудование для каждого этапа. Образцы крови берутся каждые пять минут и быстро готовятся для анализа. Концентрация 5-фторурацила в крови измеряется и сравнивается с целевым диапазоном.
Разница между целевой и измеренной концентрацией вводится в алгоритм управления, который затем корректирует скорость инфузии, если это необходимо, чтобы поддерживать дозу в диапазоне концентраций, при которых препарат эффективен и не токсичен.
"Мы разработали систему, в которой можно постоянно измерять концентрацию препарата и соответственно корректировать скорость инфузии, чтобы поддерживать концентрацию препарата в терапевтическом окне," говорит ДеРиддер.
Быстрая корректировка
В тестах на животных исследователи обнаружили, что с использованием CLAUDIA они могли поддерживать количество препарата, циркулирующего в организме, в целевом диапазоне около 45 процентов времени.
Уровни препарата у животных, получавших химиотерапию без CLAUDIA, оставались в целевом диапазоне только 13 процентов времени в среднем. В этом исследовании исследователи не проводили тесты эффективности уровней препарата, но считается, что поддержание концентрации в целевом окне приводит к лучшим результатам и меньшей токсичности.
CLAUDIA также могла поддерживать дозу 5-фторурацила в целевом диапазоне даже при введении препарата, ингибирующего фермент DPD. У животных, получавших этот ингибитор без непрерывного мониторинга и корректировки, уровни 5-фторурацила увеличивались до восьми раз.
Для этой демонстрации исследователи вручную выполняли каждый этап процесса, используя готовое оборудование, но теперь планируют автоматизировать каждый этап, чтобы мониторинг и корректировка дозы могли проводиться без вмешательства человека.
Для измерения концентраций препарата исследователи использовали высокоэффективную жидкостную хроматографию-масс-спектрометрию (HPLC-MS), технику, которую можно адаптировать для обнаружения практически любого типа препарата.
"Мы видим будущее, в котором сможем использовать CLAUDIA для любого препарата, обладающего подходящими фармакокинетическими свойствами и обнаруживаемого с помощью HPLC-MS, что позволит персонализировать дозирование для многих различных препаратов," говорит ДеРиддер.
