Новые публикации
Препарат LM11A-31 замедляет прогрессирование болезни Альцгеймера в испытаниях
Последняя редакция: 02.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

В недавнем исследовании, опубликованном в журнале Nature Medicine, ученые провели рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы 2а, чтобы изучить безопасность и эффективность LM11A-31 в лечении болезни Альцгеймера (БА) через модуляцию рецептора нейротрофинов p75 (p75NTR).
Поздняя форма БА является наиболее распространенной формой деменции, характеризующейся синаптической недостаточностью, дегенерацией и утратой нервных клеток. Хотя два основных препарата для лечения БА нацелены на накопление аномального амилоида-β или белка тау, они решают только часть патофизиологии. Другой подход заключается в воздействии на рецепторы и сигнальные сети, которые влияют на фундаментальные биологические пути. Предклинические исследования показывают, что модуляция p75NTR с помощью новой малой химической молекулы LM11A-31 снижает потерю синапсов, вызванную амилоидом и патологическим тау.
Описание исследования
В данном рандомизированном клиническом исследовании ученые изучали, может ли LM11A-31 замедлить прогрессирование болезни Альцгеймера путем модуляции p75NTR у людей.
Участникам исследования давали пероральные капсулы LM11A-31 в дозах 200 мг и 400 мг или плацебо в соотношении 1:1:1 242 пациентам с легкой и умеренной формой БА в течение 26 недель. Участники имели биологически подтвержденную болезнь Альцгеймера (уровень амилоида β белка 42 (Aβ42) в цереброспинальной жидкости ниже 550 нг/л или отношение Aβ42:β40 ниже 0,89), диагностированную по критериям McKhann, с оценками по Мини-психиатрической шкале (MMSE) от 18 до 26, оценками по Гериатрической шкале депрессии (GDS) ниже 5,0, оценками по измененной ишемической шкале Хачински (HIS) ≤ 4,0, формальным образованием ≥ 8 лет и предыдущим когнитивным снижением ≥ 6 месяцев.
Подходящие участники принимали ингибиторы ацетилхолинэстеразы (AChEIs) или частичные антагонисты рецепторов NMDA ≥ 3 месяцев до начала исследования. Они не принимали запрещенные лекарства, такие как нейролептики, бензодиазепины, противоэпилептические препараты, седативные средства, центрально активные антигипертензивные препараты, ноотропы (кроме гинкго билоба) или анальгетики, содержащие опиоиды.
Основным исходом исследования была безопасность и переносимость препарата, оцененные с помощью шкалы оценки тяжести суицидальных мыслей и поведения Колумбийского университета (C-SSRS), жизненных показателей, артериального давления и гематологических параметров. Для оценки вторичных когнитивных исходов использовались структурная магнитно-резонансная томография (сMRI), позитронно-эмиссионная томография с фтордезоксиглюкозой (FDG-PET) и биомаркеры цереброспинальной жидкости (CSF). Показатели БА включали тау, фосфорилированный в позиции Thr181, общий белок тау, Aβ40, Aβ42 и активность AChE. Команда использовала индивидуализированный нейропсихологический тест для оценки вторичных когнитивных исходов на исходном уровне, на 12-й и 26-й неделях.
Результаты исследования
Исследование показало, что LM11A-31 безопасен и хорошо переносится, без серьезных проблем с безопасностью. Наиболее распространенные побочные эффекты включали головную боль, диарею, эозинофилию и назофарингит, причем желудочно-кишечные проблемы и эозинофилия были основными причинами прекращения приема препарата. В группе с дозой 400 мг было больше случаев прекращения приема препарата по сравнению с группами с дозой 200 мг и плацебо. МРТ не выявила проблем с безопасностью препарата, включая аномалии, связанные с амилоидом. Существенных различий в когнитивных оценках или амилоидных аномалиях между двумя группами лечения не было.
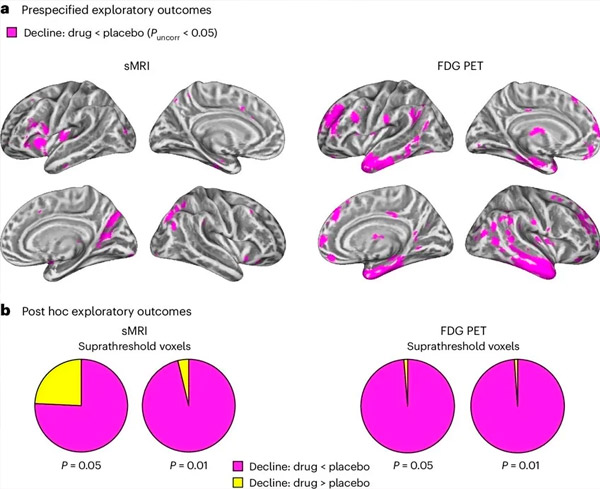
А. В анализе двухфакторных смешанных моделей ковариационного анализа изучались взаимодействия между лечением (препарат или плацебо) и временем (до или после лечения). Односторонний t-контраст, исследующий гипотезу взаимодействия (препарат замедляет прогрессию по сравнению с плацебо), показал, что лечение LM11A-31 замедляло продольную дегенерацию (левые панели) и гипометаболизм глюкозы (правые панели) в группе, получавшей препарат (сMRI, n = 127; ПЭТ, n = 121), по сравнению с группой плацебо (сMRI, n = 66; ПЭТ, n = 62). Воксели, демонстрирующие это взаимодействие, показаны при некорректированном пороге P < 0,05 (магентовый цвет) на популяционно-специфической кортикальной поверхности. Левые и правые полушария показаны в верхнем и нижнем рядах соответственно. Области мозга, демонстрирующие взаимодействия, не соответствующие гипотезе, показаны на Рисунке 7 в дополнительных данных.
Б. Общее количество вокселов в заранее определенных уязвимых областях мозга при БА (общая площадь круговых диаграмм), демонстрирующих либо взаимодействие, соответствующее гипотезе (магентовый цвет), либо взаимодействие, не соответствующее гипотезе (желтый цвет), в каждом из методов визуализации (сMRI, левая панель; ПЭТ FDG, правая панель) при все более либеральных порогах некорректированного P < 0,01 и P < 0,05. Моделирование Монте-Карло показало, что соотношения вокселов, демонстрирующих эффекты, соответствующие гипотезе, по сравнению с теми, что не соответствуют гипотезе, были значительно выше, чем те, что наблюдаются на основе случайно сгенерированных данных, как для сMRI, так и для ПЭТ (P < 0,001 для каждого метода; двухсторонний тест).
LM11A-31 эффективно снижал повышение Aβ42 и Aβ40 в CSF по сравнению с группой плацебо. Препарат также показал снижение медианного годового процентного изменения в биомаркере пресинаптического белка SNAP25 и снижение постсинаптического биомаркера NG, что указывает на замедление потери пресинаптических и постсинаптических соединений. LM11A-31 также снижал рост YKL40, что приводило к уменьшению оценок MMSE и увеличению оценок ADAS-Cog-13. Препарат также уменьшал потерю серого вещества в лобной доле и задней теменной коре и снижение метаболизма глюкозы в таких областях, как энторинальная кора, височная кора, гиппокамп, островковая кора и префронтальная кора.
Заключение
Исследование пришло к выводу, что модуляция p75NTR с помощью LM11A-31 подходит для более масштабных клинических исследований. LM11A-31 соответствовал основному критерию безопасности и был хорошо переносим пациентами с легкой и тяжелой формами БА. Результаты указывают на необходимость дальнейших исследований с более длительным лечением для оценки возможности использования малых молекул для регулирования p75NTR в качестве модифицирующей терапии при БА. Исследование показало, что LM11A-31 существенно влияет на несколько биомаркеров, включая Aβ40, Aβ42, SNAP25, NG и YKL40, что указывает на замедление патологического развития. Будущие исследования могут оценить дополнительные индикаторы состояния глии.
