Новые публикации
Новые генетические механизмы могут стать терапевтической мишенью против глиомы
Последняя редакция: 02.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В исследовании лаборатории Ши-Юань Ченга, доктора философии, профессора в отделении нейроонкологии Кена и Руф Дэви в Департаменте неврологии, были выявлены новые механизмы, лежащие в основе событий альтернативного сплайсинга РНК в клетках опухолей глиомы, которые могут служить новыми терапевтическими мишенями. Результаты исследования опубликованы в Journal of Clinical Investigation.
"Мы нашли другой способ лечения глиомы через призму альтернативного сплайсинга и обнаружили новые мишени, которые ранее не были идентифицированы, но важны для злокачественности глиомы," сказал Сяо Сонг, доктор медицинских наук, доцент кафедры неврологии и ведущий автор исследования.
Глиомы являются наиболее распространенным типом первичных опухолей мозга у взрослых и происходят из глиальных клеток, которые находятся в центральной нервной системе и поддерживают соседние нейроны. Глиомы очень устойчивы к стандартным методам лечения, включая радиацию и химиотерапию, из-за генетической и эпигенетической гетерогенности опухоли, что подчеркивает необходимость поиска новых терапевтических мишеней.
Предыдущие исследования лаборатории Ченга, опубликованные в журнале Cancer Research, показали, что важный фактор сплайсинга SRSF3 значительно повышен в глиомах по сравнению с нормальными мозгами, и регулируемый SRSF3 сплайсинг РНК способствует росту и прогрессированию глиом, влияя на множество клеточных процессов в опухолевых клетках.
Сплайсинг РНК - это процесс, который включает удаление интронов (некодирующих участков РНК) и соединение экзонов (кодирующих участков) для формирования зрелой молекулы мРНК, поддерживающей экспрессию генов в клетке.
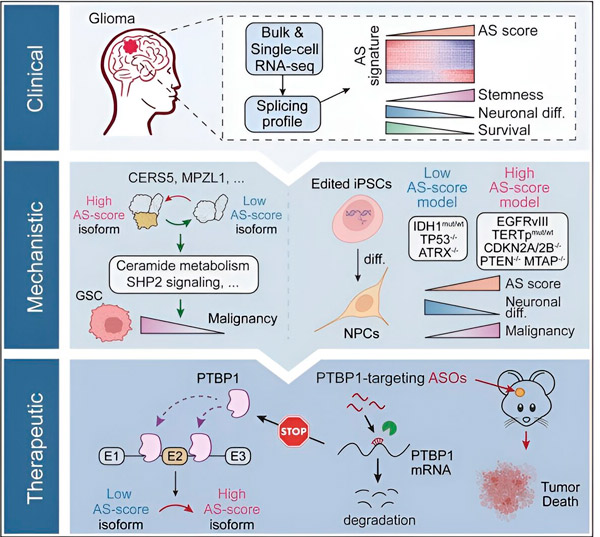
В настоящем исследовании ученые поставили цель идентифицировать изменения альтернативного сплайсинга в клетках опухолей глиомы, механизмы, лежащие в основе этих изменений, и определить их потенциал в качестве терапевтических мишеней.
С использованием вычислительных методов и технологий секвенирования РНК, исследователи изучили изменения сплайсинга в клетках опухолей глиомы из образцов пациентов. Для подтверждения этих изменений они использовали технологии редактирования генов CRISPR для введения различных мутаций-драйверов глиомы в модели глиомы, полученные из индуцированных плюрипотентных стволовых клеток (iPSC) человека.
Они обнаружили, что эти изменения сплайсинга усиливаются вариантным рецептором эпидермального фактора роста III (EGFRIII), который известно, что он сверхэкспрессирован во многих опухолях, включая глиомы, и ингибируются мутацией гена IDH1.
Исследователи подтвердили функцию двух событий сплайсинга РНК, которые создают различные изоформы белка с различными последовательностями аминокислот.
"Только одна из этих изоформ может способствовать росту опухоли, в отличие от другой изоформы, которая обычно экспрессируется в нормальном мозге. Опухоли используют этот механизм для селективной экспрессии опухоль-промотирующей изоформы над нормальной мозговой изоформой," сказал Сонг.
Далее команда проанализировала upstream РНК-связывающие белки и обнаружила, что ген PTBP1 регулирует опухоль-промотирующий сплайсинг РНК в клетках глиомы. С использованием ортотопической модели глиомы на иммунодефицитных мышах, исследователи нацелились на PTBP1 с помощью терапии на основе антисмысловой олигонуклеотиды (ASO), что в конечном итоге подавило рост опухоли.
"Наши данные подчеркивают роль альтернативного сплайсинга РНК в влиянии на злокачественность и гетерогенность глиомы и его потенциал в качестве терапевтической уязвимости для лечения взрослых глиом," написали авторы исследования.
Следующим шагом исследователи планируют изучить потенциал нацеливания на PTBP1 для вызова антиопухолевого иммунного ответа, сказал Сонг.
"С помощью анализа длинного чтения РНК-секвенирования мы обнаружили, что нацеливание на PTBP1 в клетках глиомы приводит к образованию множества альтернативно сплайсированных транскриптов, отсутствующих в нормальных тканях. Поэтому наш следующий проект - выяснить, может ли эта изоформа генерировать некоторые антигены, чтобы иммунная система могла лучше распознавать опухоль," сказал Сонг.
Сонг также добавила, что их команда заинтересована в анализе изменений сплайсинга в нетуморных клетках пациентов с глиомой, таких как иммунные клетки.
"Мы уже знаем, что сплайсинг очень важен для регулирования функции в клетке, поэтому он должен не только регулировать злокачественность опухоли, но также может регулировать функцию иммунных клеток, чтобы определить, могут ли они эффективно убивать рак. Поэтому мы также проводим некоторые биоинформатические анализы в опухолево-инфильтрированных иммунных клетках, чтобы выяснить, есть ли изменение сплайсинга после того, как иммунная клетка инфильтрировала опухоль.
"Наша цель - определить роль альтернативного сплайсинга в формировании иммунно-супрессивной опухолевой микросреды и выявить потенциальные мишени для повышения эффективности иммунотерапий при глиоме," сказала Сонг.
