Новые публикации
Как эмбрион «вгрызается» в материнскую ткань: впервые снята в реальном времени механика имплантации у человека
Последняя редакция: 19.08.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
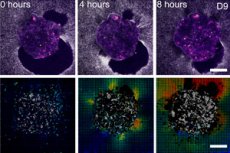
Учёные из Барселоны (IBEC, Dexeus Mujer) и Тель-Авива впервые в реальном времени и в 3D показали, как человеческий эмбрион прикрепляется к «подложке матки» и буквально тянет и перестраивает окружающую ткань. Для этого они создали деформируемую ex vivo-платформу (гели коллагена/ECM) и применили картирование тяговых сил (traction force microscopy) прямо на живых эмбрионах человека и мыши. Ключевая находка: узор сил - видоспецифичен, а сами эмбрионы механочувствительны: на внешние механические подсказки они отвечают перестройкой цитоскелета и изменением ориентации роста.
Фон исследования
Имплантация - «узкое горлышко» репродукции человека: именно на этом этапе чаще всего срываются как естественные зачатия, так и попытки ЭКО. При этом человеческая имплантация интерстициальная: эмбрион не просто «прилипает», а полностью внедряется в эндометрий - процесс биохимически и механически сложный, но до недавнего времени почти не наблюдаемый в живых системах у человека. Потому механика сцепления и инвазии оставалась «чёрным ящиком», а выводы часто делали по косвенным маркёрам или по данным животных моделей.
Классическая биология имплантации сильно опиралась на мышь, однако между видами есть принципиальные различия - от ориентации бластоцисты до глубины внедрения и рисунка клеточных сил. У мыши имплантация ближе к «поверхностной» с преимущественными направлениями смещений ткани; у человека - выраженно инвазивная, с многоочаговыми тяговыми усилиями вокруг эмбриона. Эти расхождения подсказывают: мышиная модель не всегда масштабируется на человека, особенно когда речь о механике. Нужны были прямые наблюдения человеческого эмбриона в деформируемой среде.
Технологический прорыв стал возможен благодаря совмещению деформируемых 2D/3D матриксов (коллаген/ECM) и картирования тяговых сил (traction force microscopy) с длительной высокочастотной визуализацией. Такая «искусственная матка» позволила буквально увидеть и измерить как эмбрион тянет, перестраивает и «бурит» окружающую ткань - и как он реагирует на внешние механические подсказки (механочувствительность). Это открывает путь к новым критериям оценки имплантационного потенциала и к тонкой настройке условий переноса эмбриона.
Контекст прикладной: если механические свойства среды и узор эмбриональных сил связаны с успехом имплантации, значит, в ЭКО можно целенаправленно подбирать жёсткость/состав матрикса, учитывать временные окна переноса и даже использовать «силовые» метрики как дополнительный маркёр отбора. Параллельно такие платформы помогут объяснить долю ранних потерь беременности, когда биохимия «в норме», а механика сцепления - нет. Всё это делает прямые 3D-наблюдения имплантации человека не просто красивым видео, а новым инструментом для репродуктивной медицины.
Почему это важно
Неудача имплантации - одна из главных причин бесплодия и до 60% самопроизвольных выкидышей. Несмотря на биохимический прогресс в ЭКО, механика этого процесса у человека оставалась «чёрным ящиком». Новый подход позволяет видеть силы и траектории внедрения эмбриона и даёт основу для улучшения отбора эмбрионов и условий переноса.
Как это сделали
Исследователи собрали «искусственную матку» - мягкую, прозрачную и деформируемую среду, где ткань-подобная матрица заметно смещается под действием эмбриональных сил. Дальше - непрерывная микроскопия и вычислительный анализ смещений волокон.
- 2D и 3D платформы: в 3D эмбрион сразу встраивается в матрицу (этап прикрепления как бы «обходится»), что позволяет видеть бурение в толщу ткани.
- Высокое «выживание и внедрение» в 3D: около 80% успешной инвазии (ограничивалось близостью стекла).
- Тяговые карты и цифровая корреляция объёмов показывают амплитуды и направления смещений вокруг эмбриона - фактически «отпечаток» силы во времени.
Что именно нашли (коротко и по пунктам)
1) Видоспецифическая механика имплантации
- Человек: эмбрион вставляется в матрицу, создавая множество очагов тяги и формируя радиально равномерные смещения вокруг себя; глубина инвазии - до 200 мкм.
- Мышь: эмбрион в основном расползается по поверхности с выражёнными главными направлениями смещения (principal displacement directions).
2) Эмбрион чувствует механику среды
- Внешние силы → ответ: у человеческого эмбриона - рекрутирование миозина и направленные клеточные псевдоподии; у мышиного - поворот оси имплантации/роста к источнику внешней силы (ориентация P-D-оси).
- Механочувствительные маркёры: у мыши - сдвиги локализации YAP в трофобласте; вместе это указывает на механочувствительный фидбэк-контур.
3) Связь силы и успеха имплантации
- Меньше смещение коллагена → хуже прогресс имплантации у человеческих эмбрионов.
- Интегрины - «муфта» силы: блокада RGD-пептидом/ингибирование Src у мыши режет глубину/площадь имплантации.
Как выглядит внедрение
- На 2D и 3D платформах вокруг эмбриона формируется растущий «ореол» смещений волокон; карта тяги пульсирует, будто эмбрион «сканирует» окрестности.
- На стекле человеческий эмбрион образует плоский outgrowth, а в мягкой матрице остаётся более сферичным и уходит в толщу - как в живой ткани.
Что это даёт практике (перспективы для ЭКО и не только)
Идея проста: имплантация - это не только «химия рецепторов», но и механика сцепления и тяги. Значит, мы можем оптимизировать:
- Материалы и жёсткость среды при культивации/тестах на имплантационный потенциал;
- Новые маркёры отбора эмбрионов - по траекториям и амплитуде смещений в «умной» матрице;
- Тренировку/модуляцию матки (например, через мягкие механические подсказки), чтобы улучшить сцепление без агрессивных вмешательств.
Осторожность: работа ex vivo - не «внутри матки». Но сам факт, что внешний механический сигнал меняет ориентацию имплантации/организации осей, открывает путь к персонализированным условиям переноса эмбриона.
Ограничения
- Ex vivo-модель не учитывает иммунную, гормональную и сосудистую динамику реальной эндометрия;
- Матригел/коллаген задают комплекс свойств (жёсткость, вязкоупругость, состав), их трудно менять по одному параметру;
- Этические рамки исследований человека (окно до 14 дней) ограничивают длительное наблюдение. Тем не менее, высокое совпадение с известными видами имплантации in vivo (интерстициальная у человека vs поверхностная у мыши) повышает доверие к модели.
Итог
Человеческий эмбрион активно «тянет» и «бурит» себе место в материнской ткани, а механические подсказки среды способны перенастроить его поведение. Узор сил и стратегия внедрения разные у человека и мыши - и это может объяснить, почему мышиная модель не всегда предсказывает успех имплантации у людей. Теперь механика - полноценный игрок в ранней эмбриологии и репродуктивной медицине.
Источник: Godeau A. L. и соавт. Traction force and mechanosensitivity mediate species-specific implantation patterns in human and mouse embryos. Science Advances 11(33): eadr5199 (15 августа 2025). DOI: 10.1126/sciadv.adr519
