Новые публикации
Выявлен ключевой белок, предотвращающий потерю костной массы при остеопорозе
Последняя редакция: 02.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
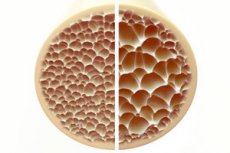
Остеопороз, состояние, характеризующееся пористостью и хрупкостью костей, представляет значительную угрозу для скелетного здоровья. Кости, являясь основной структурной опорой человеческого тела, обеспечивают жизненно важную поддержку. Когда костная масса уменьшается, это не только ухудшает эту поддержку, но и нарушает общую функцию, что приводит к снижению качества жизни.
С увеличением числа случаев остеопороза среди стареющего населения возрастает нагрузка на ресурсы здравоохранения для долгосрочного ухода. Поэтому необходимо понять механизмы, способствующие развитию остеопороза, и разработать эффективные целевые методы лечения для минимизации его долгосрочного воздействия.
Остеобласты и остеокласты – это два типа клеток, играющих ключевую роль в поддержании и ремоделировании костной ткани. В то время как остеобласты являются клетками, формирующими кости, и отвечают за синтез и отложение новой костной ткани, остеокласты – это клетки, разрушающие кости, участвующие в разложении и удалении старой или поврежденной костной ткани.
Увеличение доли остеокластов приводит к потере костной массы при таких состояниях, как остеопороз, ревматоидный артрит (воспаление суставов) и костные метастазы (рак, распространившийся на кости). Остеокласты возникают из дифференциации макрофагов или моноцитов, которые являются типами иммунных клеток.
Таким образом, подавление дифференциации остеокластов может служить терапевтической стратегией для предотвращения потери костной массы. Однако точные молекулярные механизмы, регулирующие сложный процесс ремоделирования костей, остаются неясными.
В новом исследовании профессор Тадаёши Хаята, мистер Такуто Конно и мисс Хитоми Мурачи из Токийского научного университета, вместе с коллегами, углубились в молекулярную регуляцию дифференциации остеокластов. Стимуляция лигандом рецептора активатора ядерного фактора каппа B (RANKL) вызывает дифференциацию макрофагов в остеокласты.
Кроме того, сигнальные пути костного морфогенетического белка (BMP) и трансформирующего фактора роста (TGF)-β были вовлечены в регуляцию RANKL-опосредованной дифференциации остеокластов. В текущем исследовании ученые стремились изучить роль Ctdnep1 - фосфатазы (фермента, удаляющего фосфатные группы), которая, как сообщается, подавляет сигнальные пути BMP и TGF-β.
Исследование опубликовано в журнале Biochemical and Biophysical Research Communications.
Профессор Хаята заявляет: "RANKL действует как 'ускоритель' для дифференциации остеокластов. Управление автомобилем требует не только ускорителя, но и тормозов. Здесь мы обнаружили, что Ctdnep1 выполняет роль 'тормоза' в дифференциации остеокластов."
Сначала исследователи изучили экспрессию Ctdnep1 в макрофагах мышей, обработанных RANKL, и контрольных клетках без обработки. Они отметили, что экспрессия Ctdnep1 не изменялась в ответ на стимуляцию RANKL. Однако он локализовался в цитоплазме в гранулярной форме в макрофагах и дифференцировался в остеокласты, отличаясь от своей нормальной пери-нуклеарной локализации в других типах клеток, что указывает на его цитоплазматическую функцию в дифференциации остеокластов.
Кроме того, нокаут Ctdnep1 (понижение экспрессии гена) привел к увеличению числа остеокластов, положительных на кислотную фосфатазу, устойчивую к тартрату (TRAP), где TRAP является маркером дифференцированных остеокластов.
Нокаут Ctdnep1 привел к увеличению экспрессии ключевых маркеров дифференциации, включая "Nfatc1," мастер-транскрипционный фактор, индуцированный RANKL для дифференциации остеокластов. Эти результаты подтверждают "тормозную функцию" Ctdnep1, посредством которой он отрицательно регулирует дифференциацию остеокластов. Более того, нокаут Ctdnep1 также привел к увеличению абсорбции фосфата кальция, что свидетельствует о подавляющей роли Ctdnep1 в резорбции костей.
Наконец, хотя нокаут Ctdnep1 не изменял сигнальные пути BMP и TGF-β, клетки с дефицитом Ctdnep1 показывали повышенные уровни фосфорилированных (активированных) белков, являющихся продуктами сигнального пути RANKL. Эти результаты предполагают, что подавляющий эффект Ctdnep1 в дифференциации остеокластов может не опосредоваться через сигнальные пути BMP и TGF-β, но через отрицательную регуляцию сигнального пути RANKL и уровни белка Nfatc1.
В целом, эти результаты предоставляют новые данные о процессе дифференциации остеокластов и выявляют потенциальные терапевтические мишени, которые можно использовать для разработки методов лечения, направленных на снижение потери костной массы из-за чрезмерной активности остеокластов. В дополнение к заболеваниям, характеризующимся потерей костной массы, Ctdnep1 также был идентифицирован как причинный фактор в медуллобластоме – детской опухоли мозга. Авторы оптимистично настроены, что их исследования могут быть расширены на другие человеческие заболевания, выходящие за рамки метаболизма костей.
Профессор Хаята заключает: "Наши результаты предполагают, что Ctdnep1 необходим для предотвращения чрезмерного остеокластогенеза. Эти результаты могут дополнительно расширить знания о том, как сеть фосфорилирования-дефосфорилирования контролирует дифференциацию остеокластов, и могут предоставить новые терапевтические стратегии для лечения заболеваний костей, связанных с чрезмерной активностью остеокластов."
