Новые публикации
Новое устройство улучшает генерацию стволовых клеток для терапии Альцгеймера
Последняя редакция: 14.06.2024

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

Исследователи в Швеции заявили, что усовершенствовали методику преобразования обычных кожных клеток в нейральные стволовые клетки, что, по их мнению, приближает к доступным персонализированным клеточным терапиям для лечения болезни Альцгеймера и Паркинсона.
Используя специально разработанное микрофлюидное устройство, исследовательская группа разработала беспрецедентный и ускоренный подход к перепрограммированию человеческих кожных клеток в индуцированные плюрипотентные стволовые клетки (iPSCs), а затем их превращению в нейральные стволовые клетки.
Первый автор исследования, Саумей Джайн, утверждает, что платформа может улучшить и снизить стоимость клеточной терапии, делая клетки более легко совместимыми и принимаемыми телом пациента. Исследование было опубликовано в журнале Advanced Science учеными из Королевского технологического института KTH.
Анна Херланд, старший автор исследования, заявила, что исследование продемонстрировало первый случай использования микрофлюидики для направления iPSCs к превращению в нейральные стволовые клетки.
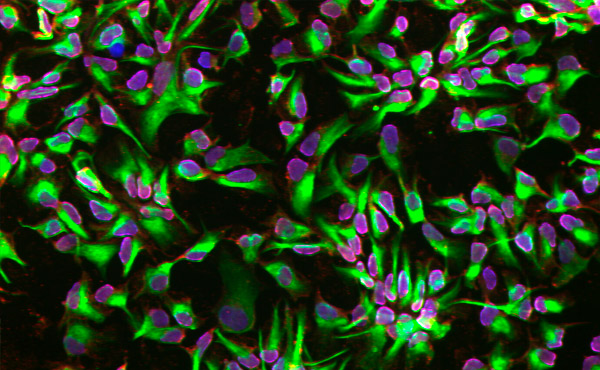
Нейральные стволовые клетки, дифференцированные с помощью микрофлюидной платформы. Фото: Королевский технологический институт KTH
Превращение обычных клеток в нейральные стволовые клетки фактически является двухэтапным процессом. Сначала клетки подвергаются воздействию биохимических сигналов, индуцирующих их в плюрипотентные стволовые клетки (iPSCs), которые могут генерировать различные типы клеток.
Затем их переносят в культуру, имитирующую сигналы и процессы развития, участвующие в формировании нервной системы. Этот этап, называемый нейральной дифференцировкой, перенаправляет клетки на путь нейральных стволовых клеток.
За последние десять лет лабораторные среды для подобных работ постепенно смещаются с традиционных планшетов на микрофлюидные устройства. Херланд утверждает, что новая платформа представляет собой улучшение микрофлюидики для обоих этапов: генерации iPSCs и дифференцировки нейральных стволовых клеток.
Используя клетки из биопсии человеческой кожи, исследователи обнаружили, что микрофлюидная платформа позволила ускорить приверженность нейральной судьбе клеток на более ранней стадии по сравнению с теми, которые дифференцировались в обычных планшетах.
"Мы задокументировали, что ограниченная среда микрофлюидной платформы усиливает приверженность к генерации нейральных стволовых клеток," говорит Херланд.
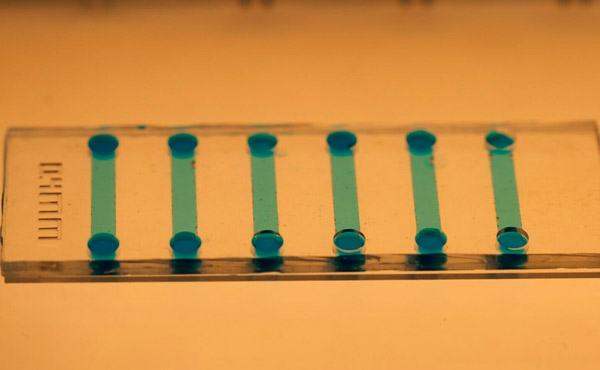
Ближайший вид микрофлюидного чипа, используемого для индукции стволовых клеток. Фото: Королевский технологический институт KTH
Джайн утверждает, что микрофлюидный чип легко изготавливается с использованием полидиметилсилоксана (PDMS), а его микроскопический размер обеспечивает значительную экономию на реагентах и клеточном материале.
Платформу можно легко модифицировать для адаптации к дифференцировке в другие типы клеток, добавляет он. Она может быть автоматизирована, обеспечивая закрытую систему, которая гарантирует согласованность и надежность в производстве высокооднородных популяций клеток.
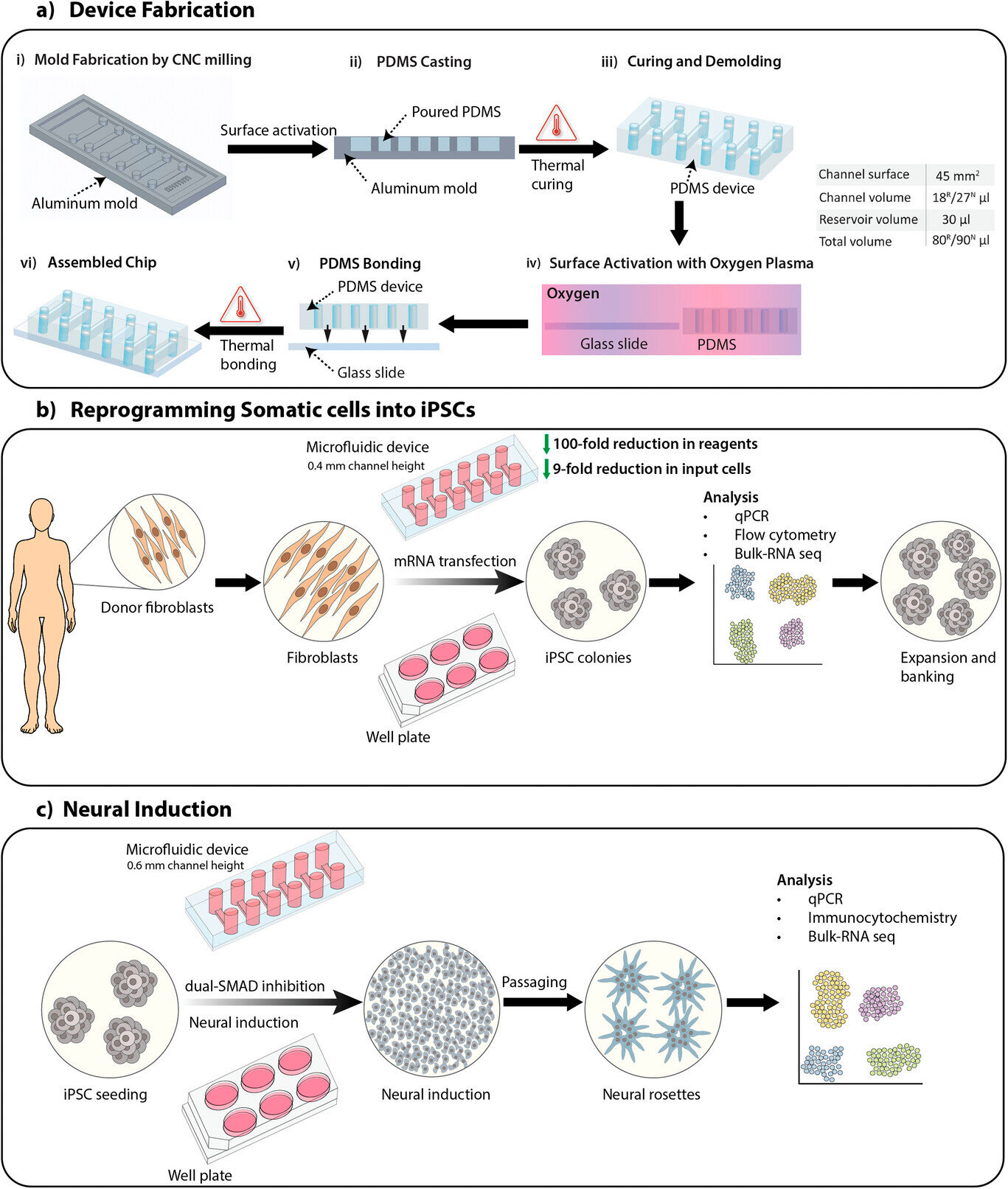
Обзор исследования, включающий изготовление устройства, перепрограммирование соматических клеток в индуцированные плюрипотентные стволовые клетки (iPSC) и нейронную индукцию iPSC с использованием протокола двойного ингибирования SMAD для получения нейронных стволовых клеток.
a) Процесс изготовления микрофлюидного устройства с каналами высотой 0,4 и 0,6 мм для перепрограммирования соматических клеток (R) и нейронной индукции (N), соответственно. Объемы каналов и общий объем указаны в таблице.
b) Обзор процесса перепрограммирования соматических клеток в iPSC на микрофлюидных устройствах и планшетах с использованием трансфекции мРНК.
c) Обзор процесса нейронной индукции iPSC в нейронные стволовые клетки на микрофлюидных устройствах и планшетах с использованием протокола двойного ингибирования SMAD.
Источник: Advanced Science (2024). DOI: 10.1002/advs.202401859
"Это шаг к тому, чтобы сделать персонализированные клеточные терапии для лечения болезни Альцгеймера и Паркинсона доступными," добавляет Джайн.
В исследовании также принимали участие ученые из Каролинского института и Лундского университета, сотрудничая в консорциуме IndiCell.
