Новые публикации
Учёные создали «хамелеон»-соединение для лечения устойчивых к лекарствам раков мозга
Последняя редакция: 14.06.2024

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В новом исследовании, проведенном учеными Йельского университета, описывается, как новое химическое соединение атакует лекарственно-устойчивые опухоли мозга, не повреждая при этом здоровые окружающие ткани.
Это исследование, опубликованное в журнале Journal of the American Chemical Society, является важным шагом в разработке так называемых "хамелеоновых соединений", которые могут быть использованы для борьбы с рядом опасных видов рака.
Глиомы развиваются примерно у 6,6 на 100 000 человек каждый год и у 2,94 на 100 000 человек в возрасте до 14 лет. За исключением метастазов других видов рака, которые достигают центральной нервной системы, глиомы составляют 26% всех опухолей головного мозга (первичные опухоли головного мозга) и 81% всех злокачественных опухолей головного мозга.
На протяжении десятилетий пациенты с глиобластомой лечились препаратом под названием темозоломид. Однако у большинства пациентов развивается устойчивость к темозоломиду в течение года. Пятилетняя выживаемость для пациентов с глиобластомой составляет менее 5%.
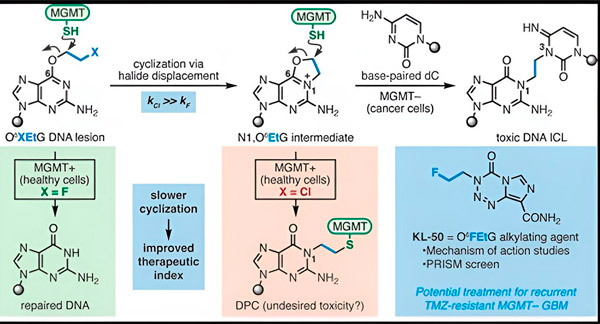
В 2022 году химик Йельского университета Сет Херзон и радиационный онколог доктор Ранджит Биндра разработали новую стратегию более эффективного лечения глиобластом. Они создали класс противораковых молекул — хамелеоновых соединений, которые используют дефект в белке восстановления ДНК, известном как O6-метилгуанин ДНК метилтрансфераза (MGMT).
Во многих раковых клетках, включая глиобластомы, белок MGMT отсутствует. Новые хамелеоновые соединения разработаны для повреждения ДНК в опухолевых клетках, лишенных MGMT.
Хамелеоновые соединения инициируют повреждение ДНК, откладывая первичные повреждения на ДНК, которые со временем превращаются в высокотоксичные вторичные повреждения, известные как межцепочечные сшивки. MGMT защищает ДНК здоровых тканей, восстанавливая первичные повреждения до того, как они могут трансформироваться в смертельно опасные межцепочечные сшивки.
Для своего нового исследования, соавторы Херзон и Биндра сосредоточились на их ведущем хамелеоне, KL-50.
"Мы использовали комбинацию синтетической химии и молекулярно-биологических исследований, чтобы выяснить молекулярную основу наших предыдущих наблюдений, а также химическую кинетику, которая обеспечивает уникальную избирательность этих соединений," — сказал Херзон, профессор химии имени Милтона Харриса в Йельском университете. "Мы показываем, что KL-50 уникален тем, что формирует межцепочечные сшивки ДНК только в опухоли с дефектом восстановления ДНК. Он щадит здоровые ткани."
Источник: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Это существенное различие, подчеркнули исследователи. Ряд других противораковых соединений был разработан для запуска межцепочечных сшивок, но они не избирательны для опухолевых клеток, что ограничивает их полезность.
Секрет успеха KL-50 заключается в его времени действия, отметили исследователи. KL-50 образует межцепочечные сшивки медленнее, чем другие сшивающие агенты. Это задержка дает здоровым клеткам достаточно времени для использования MGMT, чтобы предотвратить образование сшивок.
"Этот уникальный профиль свидетельствует о его потенциале для лечения лекарственно-устойчивой глиобластомы, что является областью с большой неудовлетворенной потребностью в клинике," — сказал Биндра, профессор терапевтической радиологии имени Харви и Кейт Кушинг в Йельской медицинской школе. Биндра также является научным директором Центра опухолей мозга имени семьи Шеневерт в больнице Смило.
Херзон и Биндра заявили, что их исследование подчеркивает важность учета скоростей химической модификации ДНК и биохимического восстановления ДНК. Они считают, что могут использовать эту стратегию для разработки лечения других видов рака, содержащих специфические дефекты восстановления ДНК, связанные с опухолями.
