Медицинский эксперт статьи
Новые публикации
Привычное невынашивание беременности - Причины
Последняя редакция: 04.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
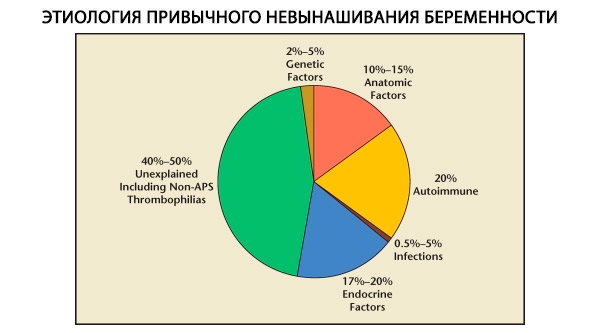
В структуре привычных потерь беременности выделяют генетические, анатомические, эндокринные, иммунологические и инфекционные факторы. При исключении всех перечисленных выше причин остается группа больных, происхождение привычного выкидыша у которых представляется неясным (идиопатические выкидыши). По данным C. Coulam и соавт. (1996), в основе 80% идиопатических выкидышей лежат нераспознанные иммунные нарушения.
Не существует убедительных данных, указывающих на эндометриоз как на причину привычного выкидыша, а также на то, что медикаментозное или хирургическое лечение эндометриоза уменьшает частоту привычного невынашивания беременности.
Согласно существующим в настоящее время представлениям, помимо генетических и частично инфекционных причин, ведущих к закладке аномального эмбриона, реализация повреждающего действия других факторов (анатомических, эндокринных, иммунологических) состоит в создании неблагоприятного фона для развития генетически полноценного плодного яйца, что ведет к истощению резервных возможностей хориона и остановке развития (эмбриогенеза). Критическими сроками в I триместре беременности признают 6–8 нед (гибель эмбриона) и 10– 12 нед (экспульсия плодного яйца).
 [1]
[1]
Генетические причины привычного невынашивания беременности
Генетические факторы в структуре причин привычного невынашивания составляют 3–6%. При спорадическом прерывании беременности в I триместре около 50% абортусов имеют хромосомные аномалии. Большинство из них (95%) составляют изменения числа хромосом - моносомия (утрата одной хромосомы), трисомия (наличие добавочной хромосомы), являющиеся результатом ошибок при мейозе, а также полиплоидия (увеличение состава хромосом на полный гаплоидный набор), возникающая при оплодотворении яйцеклетки двумя и более сперматозоидами. При спорадических выкидышах наиболее часто встречают трисомию - 60% всех мутаций (чаще всего по хромосоме 16, а также 13, 18, 21, 22), на втором месте по частоте стоит синдром Шерешевского–Тернера (хромосома 45 X0) - 20%, остальные 15% приходятся на долю полиплоидий (особенно триплоидии).
В случае наличия у абортуса изменения числа хромосом при исследовании кариотипа родителей чаще всего патологию не выявляют и вероятность хромосомной болезни плода при последующей беременности составляет 1%. В противоположность этому при исследовании абортусов у пар с привычным выкидышем в 3–6% случаев наблюдают структурные изменения хромосом (внутри- и межхромосомные). При изучении кариотипа родителей в 7% случаев обнаруживают сбалансированные хромосомные перестройки. Чаще всего это реципрокные транслокации, при которых сегмент одной хромосомы располагается на месте другого сегмента негомологичной хромосомы, а также мозаицизм половых хромосом, инверсия и обнаружение хромосом в виде кольца. В случае наличия подобных перестроек у одного из супругов при мейозе затруднены процессы спаривания и разделения хромосом, результатом чего становится утрата (делеция) или удвоение (дупликация) участков хромосом в гаметах. В результате возникают так называемые несбалансированные хромосомные перестройки, при которых эмбрион либо нежизнеспособен, либо служит носителем тяжелой хромосомной патологии. Вероятность рождения ребенка с несбалансированными хромосомными аномалиями при наличии в кариотипе одного из родителей сбалансированных хромосомных перестроек составляет 1–15%. Различия данных связаны с характером перестроек, размером вовлеченных сегментов, полом носителя, семейным анамнезом.
Диагностика
Анамнез
- Наследственные заболевания у членов семьи.
- Наличие в семье врожденных аномалий.
- Рождение детей с задержкой умственного развития.
- Наличие у супружеской пары и родственников бесплодия и/или невынашивания беременности неясного происхождения.
- Наличие неясных случаев перинатальной смертности.
Специальные методы исследования
- Исследование кариотипа родителей особенно показано супружеским парам при рождении новорожденного с пороками развития в дополнение к анамнезу невынашивания, а также при привычном невынашивании беременности на ранних сроках.
- Цитогенетический анализ абортуса в случаях мертворождения или неонатальной смертности.
Показания к консультации других специалистов
При выявлении у родителей изменений в кариотипе необходима консультация врача-генетика для оценки степени риска рождения ребенка с патологией или, при необходимости, для решения вопроса о донации яйцеклетки или сперматозоидов.
Дальнейшее ведение больной
При наличии в супружеской паре патологического кариотипа даже у одного из родителей рекомендуют проводить пренатальную диагностику во время беременности - биопсию хориона или амниоцентез - ввиду высокого риска нарушений развития у плода.
Анатомические причины привычного невынашивания беременности
К анатомическим причинам привычного невынашивания беременности относят:
- врожденные аномалии развития матки (полное удвоение матки; двурогая, седловидная, однорогая матка; частичная или полная внутриматочная перегородка);
- приобретенные анатомические дефекты;
- внутриматочные синехии (синдром Ашермана);
- субмукозную миому матки;
- истмико-цервикальная недостаточность.
Частота анатомических аномалий у пациенток с привычным выкидышем колеблется в пределах 10–16%. Частота встречаемости пороков развития матки, при которых возможно невынашивание беременности (а не бесплодие), по отношению ко всем порокам развития матки следующая: двурогая матка - 37%, седловидная матка - 15%, внутриматочная перегородка - 22%, полное удвоение матки - 11%, однорогая матка - 4,4%.
Диагностика привычного невынашивания беременности
Анамнез
При анатомической патологии матки чаще отмечают поздние прерывания беременности и преждевременные роды, однако при имплантации на внутриматочной перегородке или вблизи миоматозного узла возможны и ранние прерывания беременности.
Для истмико-цервикальной недостаточности патогномоничным признаком служит самопроизвольное прерывание беременности во II триместре или ранние преждевременные роды, происходящие относительно быстро и малоболезненно.
При пороках развития матки необходимо обращать внимание на анамнестические указания на патологию мочевыводящих путей (часто сопутствующую врожденным аномалиям матки) и характер становления менструальной функции (указания на гематометру при функционирующем рудиментарном роге матки).
Специальные методы обследования
- В настоящее время для постановки диагноза проводят гистеросальпингографию, которая позволяет изучить форму полости матки,выявить наличие субмукозных узлов миомы, синехий, перегородки, атакже определить проходимость маточных труб. С целью диагностикиматочной патологии рационально проводить гистеросальпингографию в период междуменструацией и овуляцией, т.е. в первой фазе менструального циклапосле прекращения кровянистых выделений (7–9-й день цикла). Для диагностики истмико-цервикальной недостаточности исследование проводят во второй фазе менструального цикла (18–20-й день) с целью определения состояниявнутреннего зева шейки матки. Перед проведением гистеросальпингографии необходимо исключить воспалительные заболевания органов малого таза или провести их лечение.
- Гистероскопия в последние годы получила широкое распространение и стала золотым стандартом диагностики внутриматочной патологии. Однако в связи с более высокой стоимостью по сравнению с гистеросальпингографией метод применяют у женщин с указанием на наличие внутриматочной патологии по предварительным данным ультразвукового исследования (УЗИ). При гистероскопии можно осмотреть полость матки, определить характер внутриматочной патологии и при наличии необходимого оборудования (резектоскопа) провести малотравматичное хирургическое лечение - удаление синехий, субмукозного узла миомы, полипа эндометрия. При удалении внутриматочной перегородки предпочтение отдают гистерорезектоскопии с лапароскопическим контролем, что предотвращает возможность перфорации стенки матки.
- УЗИ проводят в первой фазе менструального цикла, что позволяет предположительно поставить диагноз субмукозной миомы матки, внутриматочных синехий, а во второй фазе цикла - выявить внутриматочную перегородку и двурогую матку. Особое значение этот метод приобретает на ранних этапах беременности, когда его чувствительность при диагностике данных состояний составляет 100%, а специфичность - 80%. Вне беременности диагноз требует дополнительного подтверждения другими методами.
- Зарубежные авторы указывают на преимущество соногистерографии (УЗИ с помощью трансвагинального датчика с предварительным введением в полость матки 0,9% раствора натрия хлорида) перед гистеросальпингографией, так как она позволяет провести дифференциальную диагностику между внутриматочной перегородкой и двурогой маткой. При соногистерографии можно не только изучить форму полости матки, но и определить конфигурацию дна тела матки. В нашей стране этот метод не получил широкого распространения.
- В отдельных сложных случаях для верификации диагноза используют МРТ органов малого таза. Метод позволяет получить ценную информацию при аномалиях развития матки, сопровождающихся атипичным расположением органов в малом тазу. Проведение МРТ важно при наличии рудиментарного рога матки для решения вопроса о целесообразности его удаления. Необходимость удаления рудиментарного рога матки возникает в случае его сообщения с трубой и яичником для профилактики образования и развития в нем плодного яйца. Прерывание беременности при анатомических аномалиях матки может быть связано с неудачной имплантацией плодного яйца (на внутриматочной перегородке, вблизи субмукозного узла миомы), недостаточно развитой васкуляризацией и рецепцией эндометрия, тесными пространственными взаимоотношениями в полости матки (например, при деформации полости узлом миомы), часто сопутствующей ИЦН, и гормональными нарушениями.
Лечение привычного невынашивания беременности
Хирургическое лечение
При наличии внутриматочной перегородки, субмукозных узлов миомы и синехий наиболее эффективно оперативное лечение путем гистерорезектоскопии. Частота последующих выкидышей у данной группы женщин после лечения составляет 10% по сравнению с 90% до операции. При сопоставлении результатов метропластики, проведенной путем лапаротомии и трансцервикальной гистерорезектоскопии, Р. Heinonen (1997) получил результаты, свидетельствующие о меньшей травматичности и большей эффективности гистерорезектоскопии; процент беременностей, завершившихся рождением жизнеспособных детей, составил соответственно 68 и 86%.
Хирургическое удаление внутриматочной перегородки, синехий, а также субмукозных узлов миомы приводит к устранению невынашивания в 70–80% случаев. Однако оно не дает эффекта у женщин с пороком развития матки, имеющих в анамнезе нормальные роды с последующими повторными выкидышами. Вероятно, в подобных случаях анатомический фактор не является ведущей причиной и необходимо искать другие причины невынашивания беременности.
Доказано, что абдоминальная метропластика связана с существенным риском послеоперационного бесплодия и не улучшает прогноз последующей беременности. Поэтому предпочтение лучше отдавать гистероскопии и лапароскопическим операциям.
Медикаментозное лечение
Эффективность введения спирали, высоких доз эстрогенных препаратов, введения катетера Фолея в полость матки после проведения операций по удалению синехий, внутриматочной перегородки не доказана. Рекомендуют планировать беременность не ранее, чем через 3 мес после проведения операции. Для улучшения роста эндометрия проводят циклическую гормональную терапию в течение 3 менструальных циклов [14]. В течение 3 мес в первые 14 дней цикла целесообразен прием препарата, содержащего 2 мг 17-бета-эстрадиола, в последующие 14 дней - 2 мг 17-бета-эстрадиола и 20 мг дидрогестерона (10 мг дидрогестерона в составе комбинированного препарата плюс 10 мг дидрогестерона в отдельной таблетированной форме).
Дальнейшее ведение больной
Особенности течения беременности при двурогой матке или удвоении матки (когда существуют 2 полости матки):
- на ранних сроках беременности часто возникает кровотечение из «пустующего» рога или полости матки в связи с выраженной деци-дуальной реакцией; тактика при этом должна быть консервативной и заключаться в использовании спазмолитических и гемостатических средств;
- угроза прерывания беременности на различных сроках;
- развитие истмико-цервикальной недостаточности;
- задержка внутриутробного развития плода в связи с плацентарной недостаточностью.
На ранних сроках беременности при кровотечении целесообразны постельный и полупостельный режимы, назначение кровоостанавливающих, спазмолитических и седативных препаратов, терапия гестагенами (дидрогестерон в суточной дозе от 20 до 40 мг) до 16–18 нед гестации.
Эндокринные причины привычного невынашивания беременности
По данным разных авторов, эндокринные причины невынашивания беременности составляют от 8 до 20%. Наиболее значимыми из них признают недостаточность лютеиновой фазы (НЛФ), гиперсекрецию ЛГ, дисфункцию щитовидной железы, сахарный диабет.
Тяжелые заболевания щитовидной железы или сахарный диабет могут привести к повторным прерываниям беременности. Однако при компенсированном сахарном диабете риск привычных выкидышей не отличается от такового в популяции.
В то же время высокая частота гипотиреоза в популяции требует скрининга с измерением уровня ТТГ. У больных с привычным выкидышем недостаточность лютеиновой фазы наблюдают в 20–60% случаев, а ультразвуковые признаки поликистозных яичников - в 44–56%. По данным литературы, влияние отдельно взятых гормональных нарушений на формирование симптомокомплекса привычного выкидыша остается дискуссионным. Исследования M. Ogasawara и соавт. (1997) не выявили достоверных различий в частоте прерывания беременности при наличии НЛФ и без таковой у пациенток с двумя и более ранними выкидышами в анамнезе при исключении аутоиммунных, анатомических и инфекционных причин.
Недостаточность функции желтого тела может быть результатом действия целого ряда неблагоприятных факторов:
- нарушения секреции ФСГ и ЛГ в первой фазе менструального цикла;
- раннего или, наоборот, слишком позднего пика выброса ЛГ;
- гипоэстрогении как следствия неполноценного фолликулогенеза.Все эти состояния не подвергаются коррекции заместительной терапией гестагенными препаратами в постовуляторный период. Проспективные исследования, проведенные L. Regan и соавт., показалидостоверное увеличение частоты выкидышей у пациенток с гиперсекрецией ЛГ на 8-й день менструального цикла по сравнению с женщинами с нормальным уровнем ЛГ в крови (65% и 12% выкидышей соответственно). Повреждающее действие несвоевременного выброса ЛГ связывают с преждевременным возобновлением второго мейотического деления и овуляцией незрелой яйцеклетки, а также с индукцией продукции андрогенов клетками теки наряду с нарушением рецепции эндометрия под действием гестагенной недостаточности. Однако предварительное снижение предовуляторного уровня ЛГ агонистами гонадолиберинов без дополнительных мер, направленных на пролонгирование последующей беременности, не дает ожидаемого снижения частоты выкидышей.
Золотым стандартом диагностики НЛФ служит гистологическое исследование материала, полученного при биопсии эндометрия во второй фазе цикла в течение 2 менструальных циклов.
Диагностику других причин овуляторной дисфункции, например гиперпролактинемии, гипотиреоза, функционального избытка андрогенов (яичниковых или надпочечниковых), необходимо сопровождать назначением соответствующего лечения.
Диагностика
Анамнез и физикальное обследование
- Анамнез. Факторы, на которые необходимо обратить внимание: позднее менархе, нерегулярный менструальный цикл (олигоменорея, аменорея, резкая прибавка массы тела, потеря массы тела, бесплодие, привычные выкидыши на ранних сроках).
- Осмотр: особенности телосложения, рост, масса тела, гирсутизм, выраженность вторичных половых признаков, наличие стрий, осмотр молочных желез на предмет галактореи.
- Тесты функциональной диагностики: измерение ректальной температуры в течение 3 менструальных циклов.
Специальные методы исследования
- Гормональное исследование:
- в 1-й фазе менструального цикла (7–8-й день) - определение содержания ФСГ, ЛГ, пролактина, ТТГ, тестостерона, 17-гидроксипрогестерона (17-ОП), ДГЭАС;
- во 2-й фазе менструального цикла (21–22-й день) - определение содержания прогестерона (нормативные показатели уровня прогестерона очень вариабельны, метод нельзя применять без учета других факторов).
- УЗИ:
- в 1-й фазе менструального цикла (5–7-й день) - диагностика патологии эндометрия, поликистозных яичников;
- во 2-й фазе менструального цикла (20–21-й день) - измерение толщины эндометрия (норма 10–11 мм, коррелирует с содержанием прогестерона).
- Биопсию эндометрия для верификации НЛФ производят за 2 дня до предполагаемой менструации (на 26-й день при 28-дневном цикле). Подобный метод используют в случаях, когда диагноз представляется неясным. Для изучения изменений в эндометрии в так называемом периоде «окна имплантации» биопсию производят на 6-й день после овуляции.
Лечение
При диагностике НЛФ (по графикам ректальной температуры продолжительность 2-й фазы составляет менее 11 дней, наблюдают ступенчатое повышение температуры, недостаточную секреторную трансформацию эндометрия по данным биопсии эндометрия, низкий уровень прогестерона в сыворотке крови) необходимо выявить причину подобных нарушений.
Если НЛФ сопровождает гиперпролактинемия, проводят МРТ головного мозга. Альтернативный метод - рентгенография черепа (область турецкого седла).
Первый этап при гиперпролактинемии - исключение аденомы гипофиза, требующей оперативного лечения. При отсутствии выраженных изменений гиперпролактинемию расценивают как функциональную, и назначают лечение бромокриптином с целью нормализации уровня пролактина. Начальная доза бромокриптина составляет 1,25 мг/сут в течение 2 нед, после контроля уровня пролактина при отсутствии нормализации показателей дозу увеличивают до 2,5 мг/сут. При выраженном повышении уровня пролактина начальная доза составляет 2,5 мг/сут. При наступлении беременности бромокриптин должен быть отменен.
При обнаружении гипотиреоза устанавливают характер патологии щитовидной железы совместно с эндокринологом. В любом случае показана терапия левотироксином натрия ежедневно, дозу подбирают индивидуально до нормализации уровня ТТГ. При наступлении беременности лечение левотироксином натрия необходимо продолжить. Вопрос о целесообразности увеличения дозы в I триместре беременности решают совместно с эндокринологом после получения результатов гормонального обследования (уровень ТТГ, свободного тироксина).
Собственно коррекцию НЛФ осуществляют одним из двух способов. Первый путь - стимуляция овуляции, второй путь - заместительная терапия препаратами прогестерона.
Первый вариант лечения: стимуляция овуляции кломифена цитратом. Данный метод лечения основан на том, что большинство нарушений лютеиновой фазы закладывается в фолликулярную фазу цикла. Постоянно сниженный уровень прогестерона во 2-й фазе становится следствием нарушенного фолликулогенеза в 1-й фазе цикла. Это нарушение с большим успехом будет скорригировано низкими дозами кломифена цитрата в ранней фолликулярной фазе, чем назначение прогестерона во 2-й фазе цикла.
В 1-м цикле доза кломифена цитрата составляет 50 мг/сут с 5-го по 9-й день менструального цикла. Эффективность контролируют по графикам ректальной температуры, измерению уровня прогестерона во 2-й фазе цикла или при динамическом УЗИ. При отсутствии достаточного эффекта во 2-м цикле стимуляции овуляции доза кломифена цитрата должна быть увеличена до 100 мг/сут с 5-го по 9-й день цикла. Максимально возможная доза в 3-м цикле стимуляции овуляции - 150 мг/сут. Подобное увеличение дозы возможно лишь при нормальной переносимости препарата (отсутствии интенсивных болей внизу живота и пояснице и других признаков гиперстимуляции яичников).
Второй вариант лечения: заместительная терапия препаратами прогестерона, которые способствуют полноценной секреторной трансформации эндометрия, что дает необходимый эффект у больных с привычным невынашиванием беременности при сохранной овуляции. Кроме того, в последние годы установлено, что назначение препаратов прогестерона оказывает не только гормональное, но и иммуномодулирующее воздействие, подавляя реакции отторжения со стороны иммунокомпетентных клеток в эндометрии. В частности, подобный эффект описан для дигидрогестерона в дозе 20 мг/сут. С целью заместительной терапии используют дидрогестерон в дозе 20 мг/сут внутрь или микронизированный прогестерон вагинально в дозе 200 мг/сут. Лечение проводят на 2-й день после овуляции (на следующий день после повышения ректальной температуры) и продолжают 10 дней. При наступлении беременности лечение препаратами прогестерона должно быть продолжено.
Современные исследования не подтвердили эффективность применения хорионического гонадотропина человека в лечении привычного невынашивания беременности.
При гиперандрогении (яичникового или надпочечникового генеза) у пациенток с привычным невынашиванием беременности показано медикаментозное лечение ввиду воздействия андрогенов на полноценность овуляции и состояние эндометрия. При нарушении биосинтеза надпочечниковых андрогенов возможно их вирилизующее влияние на плод женского пола, поэтому стероидную терапию проводят в интересах плода.
Гиперандрогения яичникового генеза (поликистозные яичники)
Анамнез, результаты физикального и специального обследования
- Анамнез: позднее менархе, нарушение менструального цикла по типу олигоменореи (чаще первичной, реже вторичной). Беременности наступают редко, как правило самопроизвольно прерываются в I триместре, между беременностями длительные периоды бесплодия.
- Осмотр: гирсутизм, акне, стрии, высокий индекс массы тела (не обязательно).
- Графики ректальной температуры: ановуляторные циклы чередуются с циклами с овуляцией и НЛФ.
- Гормональное исследование: высокий уровень тестостерона, можетбыть повышен уровень ФСГ и ЛГ, соотношение ЛГ/ФСГ больше 3.УЗИ: поликистозные яичники.
Лечение
Немедикаментозное лечение
Снижение массы тела - диетотерапия, физическая нагрузка.
Медикаментозное лечение
- Орлистат в дозе 120 мг с каждым основным приемом пищи. Продолжительность курса определяют с учетом эффекта и переносимости.
- Предварительное снижение уровня тестостерона препаратами, содержащими ципротерона ацетат (2 мг) и ЭЭ (35 мкг), в течение 3 менструальных циклов.
- Отмена контрацептива, гормональная поддержка второй фазы цикла (терапия гестагенами) - дидрогестерон в дозе 20 мг/сут с 16-го по 25-й день менструального цикла. При отсутствии самостоятельной овуляции переходят к следующему этапу.
- Стимуляция овуляции кломифена цитратом в начальной дозе 50 мг/сут с 5-го по 9-й день менструального цикла с одновременной терапией гестагенами (дидрогестерон в дозе 20 мг/сут с 16-го по 25-й день цикла) и дексаметазоном (0,5 мг).
- При отсутствии беременности дозу кломифена цитрата увеличивают до 100–150 мг/сут с назначением гестагенов во второй фазе цикла и дексаметазона (0,5 мг). Было установлено, что, хотя дексаметазон снижает только уровень надпочечниковых андрогенов, овуляция и зачатие наступают достоверно чаще при лечении кломифеном цитрата и дексаметазоном, чем при использовании только кломифена цитрата [12].
- Проводят 3 цикла стимуляции овуляции, после чего рекомендуют перерыв в течение 3 менструальных циклов с гестагенной поддержкой и решением вопроса об оперативном лечении лапароскопическим доступом (клиновидная резекция яичников, лазерная вапоризация).
Дальнейшее ведение больной
Ведение беременности необходимо сопровождать гестагенной поддержкой до 16 нед беременности (дидрогестерон в дозе 20 мг/сут или микронизированный прогестерон в дозе 200 мг/сут), дексаметазон назначают только в I триместре беременности. Обязателен мониторинг для своевременной диагностики истмико-цервикальной недостаточности и при необходимости ее хирургическая коррекция.
Надпочечниковая гиперандрогения (пубертатный и постпубертатный адреногенитальный синдром)
Адреногенитальный синдром (АГС) - наследственное заболевание, связанное с нарушением синтеза гормонов коры надпочечников вследствие поражения генов, отвечающих за синтез ряда ферментных систем. Заболевание наследуется аутосомно-рецессивно с передачей мутантных генов от обоих родителей, которые являются здоровыми носителями.
В 90% случаев адреногенитальный синдром обусловлен мутациями в гене CYP21В, приводящими к нарушению синтеза 21-гидроксилазы.
Анамнез, результаты физикального и специального обследования
- Анамнез: позднее менархе, менструальный цикл несколько удлинен, возможна олигоменорея, самопроизвольные прерывания беременностей в I триместре, может быть бесплодие.
- Осмотр: акне, гирсутизм, андроидный тип телосложения (широкие плечи, узкий таз), гипертрофия клитора.
- Графики ректальной температуры: ановуляторные циклы чередуются с циклами с овуляцией и НЛФ.
- Гормональное исследование: высокий уровень 17-ОП, ДГЭАС.
- УЗИ: яичники не изменены.
Патогномоничным признаком вне беременности служит увеличение концентрации в плазме крови 17-ОП.
В настоящее время для диагностики скрытой, неклассической формы надпочечниковой гиперандрогении проводят пробу с АКТГ. Для этой пробы применяют синактен - синтетический полипептид, обладающий свойствами эндогенного АКТГ, т.е. стимулирующий в надпочечниках начальные фазы синтеза стероидных гормонов из холестерина.
Проба с синактеном (аналогом АКТГ): п/к вводят в плечо 1 мл (0,5 мг) синактена, предварительно определяют исходное содержание 17-ОП и кортизола в утреннем 9-часовом образце плазмы крови. Контрольный забор крови производят через 9 ч после инъекции для определения уровня 17-ОП и кортизола. В дальнейшем проводят подсчет индекса детерминации (D) по формуле:
D = 0,052 × 17-ОП + 0,005 × Кортизол / 17-ОП - 0,018 × Кортизол / 17-ОП
Если коэффициент D меньше или равен 0,069, это свидетельствует об отсутствии надпочечниковой гиперандрогении. При коэффициенте D более 0,069 следует считать, что гиперандрогения обусловлена нарушением функции надпочечников.
Медикаментозное лечение
Основу лечения гиперандрогении, обусловленной дефицитом 21-гидроксилазы, составляют глюкокортикоиды, которые применяют с целью подавления избыточной секреции андрогенов.
Дальнейшее ведение больной
В связи с вирилизующим воздействием андрогенов матери на плод при установленном диагнозе надпочечниковой гиперандрогении лечение дексаметазоном в начальной дозе 0,25 мг назначают до наступления беременности и продолжают в индивидуально подобранной дозе (от 0,5 до 1 мг) в течение всей беременности. У женщины с привычным невынашиванием беременности, страдающей надпочечниковой гиперандрогенией, отменять лечение нецелесообразно, так как частота выкидышей при отсутствии лечения достигает 14%, при продолжении - 9%.
Учитывая тот факт, что пациентки с адреногенитальным синдромом могут передать этот ген плоду, необходимо проводить пренатальную диагностику: в 17–18 нед беременности назначают исследование крови матери для определения содержания 17-ОП. При повышенном уровне гормона в крови определяют концентрацию его в амниотической жидкости. Если содержание 17-ОП в амниотической жидкости повышено, диагностируют адреногенитальный синдром у плода. К сожалению, по уровню 17-ОП в околоплодных водах невозможно определить степень тяжести адреногенитального синдрома (легкая или сольтеряющая тяжелая форма). Вопрос о сохранении беременности в данной ситуации решают родители.
Если отец ребенка - носитель гена адреногенитального синдрома и в семье были случаи рождения детей с этим синдромом, то пациентка даже без надпочечниковой гиперандрогении получает дексаметазон в интересах плода (для предотвращения вирилизации плода женского пола) в дозе 20 мкг/кг массы, максимум 1,5 мг/сут в 2–3 приема после еды. В 17–18 нед после решения вопроса о половой принадлежности плода и экспрессии гена адреногенитального синдрома (по результатам амниоцентеза) лечение продолжают до конца беременности, если плод - девочка с адреногенитальным синдромом. Если плод - мальчик или девочка, не являющиеся носителем гена адреногенитального синдрома, прием дексаметазона можно отменить.
Если женщина с привычным невынашиванием беременности страдает надпочечниковой гиперандрогенией, то лечение дексаметазоном проводят в течение всей беременности и отменяют только после родов. На 3-й день после родов дозу дексаметазона постепенно снижают (на 0,125 мг каждые 3 дня) до полной отмены в послеродовом периоде.
Гиперандрогения смешанного генеза (яичниковая и надпочечниковая)
Анамнез, результаты физикального и специального обследования
- Анамнез: позднее менархе, нарушение менструального цикла по типу олигоменореи (чаще первичной, реже вторичной), аменорея, возможны травмы, сотрясения мозга. Беременности наступают редко, как правило, самопроизвольно прерываются в I триместре, между беременностями длительные периоды бесплодия.
- Физикальное обследование: гирсутизм, акне, стрии, acanthosis nigricans, высокий индекс массы тела, артериальная гипертензия.
- Графики ректальной температуры: ановуляторные циклы чередуются с циклами с овуляцией и НЛФ.
- Гормональное исследование: высокий уровень тестостерона, может быть повышен уровень ФСГ и ЛГ, соотношение ЛГ/ФСГ больше 3, высокий уровень ДГЭАС, 17-ОП, может быть гиперпролактинемия.
- УЗИ: поликистозные яичники.
- Электроэнцефалография: изменения биоэлектрической активности мозга.
- Гиперинсулинемия, нарушение липидного обмена (высокий уровень холестерина, липопротеинов низкой и очень низкой плотности), сниженная толерантность к глюкозе или повышенный уровень глюкозы в крови.
Лечение
Немедикаментозное лечение
Снижение массы тела (низкокалорийная диета, физическая активность).
Медикаментозное лечение
Первый этап - при наличии инсулинорезистентности рекомендуют назначение метформина в суточной дозе 1000–1500 мг для повышения чувствительности к инсулину.
Второй этап - при выраженных нарушениях менструального цикла и высоком уровне тестостерона показано назначение препаратов с антиандрогенным эффектом, содержащих ципротерона ацетат (2 мг) и этинилэстрадиол (35 мкг), на 3 мес.
Третий этап - стимуляция овуляции с последующей гестагенной поддержкой (схема описана выше) и приемом дексаметазона в суточной дозе 0,25–0,5 мг.
При гиперпролактинемии и гипотиреозе должна быть проведена соответствующая медикаментозная коррекция в циклах стимуляции овуляции. При наступлении беременности бромокриптин должен быть отменен, прием левотироксина продолжен.
При неэффективной стимуляции овуляции должен быть решен вопрос о назначении прямых индукторов овуляции, целесообразности хирургического лечения поликистозных яичников или экстракорпорального оплодотворения.
Дальнейшее ведение больной
У пациенток с метаболическим синдромом беременность нередко осложняют артериальную гипертензию, нефропатия, гиперкоагуляция, в связи с чем обязательны контроль артериального давления, гемостазиограммы с ранних сроков беременности и коррекция возникающих нарушений (при необходимости) гипотензивными препаратами, антиагрегантами и антикоагулянтами. Гестагенные препараты назначают до 16 нед беременности - дид-рогестерон в дозе 20 мг/сут или микронизированный прогестерон в дозе 200 мг/сут в 2 приема.
Все женщины с гиперандрогенией представляют группу риска развития истмико-цервикальной недостаточности. Мониторинг за состоянием шейки матки необходимо осуществлять с 16 нед беременности, при необходимости - хирургическая коррекция истмико-цервикальной недостаточности.
Иммунологические причины привычного невынашивания беременности
В настоящее время известно, что около 80% всех ранее необъяснимых случаев повторных потерь беременности (после исключения генетических, анатомических, гормональных причин) связано с иммунными нарушениями. Выделяют аутоиммунные и аллоиммунные нарушения, ведущие к привычному невынашиванию беременности.
При аутоиммунных процессах предметом агрессии иммунной системы становятся собственные ткани материнского организма, т.е. имеет место направленность иммунного ответа против собственных антигенов. В этой ситуации плод страдает вторично в результате повреждения материнских тканей.
При аллоиммунных нарушениях иммунный ответ женщины направлен против антигенов эмбриона/плода, полученных от отца и являющихся потенциально чужеродными для организма матери.
К аутоиммунным нарушениям, наиболее часто встречающимся у больных с привычным выкидышем, относят наличие в сыворотке ан-тифосфолипидных, антитиреоидных, антинуклеарных аутоантител. Так, установлено, что у 31% женщин с привычным невынашиванием вне беременности обнаруживают аутоантитела к тироглобулину, пероксидазе щитовидной железы (thyroid microsomal [thyroid peroxidase] autoantibodies); в этих случаях риск самопроизвольного выкидыша в I триместре беременности возрастает до 20%. При привычном невынашивании беременности наличие антинуклеарных и антитиреоидных антител указывает на необходимость дальнейшего обследования для выявления аутоиммунного процесса и верификации диагноза.
Общепризнанным аутоиммунным состоянием, ведущим к гибели эмбриона/плода, в настоящее время остается антифосфолипидный синдром (АФС).
Аллоиммунные нарушения
В настоящее время к аллоиммунным процессам, ведущим к отторжению плода, относят наличие у супругов повышенного (более 3) количества общих антигенов системы главного комплекса гистосовместимости (часто наблюдают при родственных браках); низкий уровень блокирующих факторов в сыворотке матери; повышенное содержание естественных клеток-киллеров (NK-клеток CD56, CD16) в эндометрии и периферической крови матери как вне, так и во время беременности; высокие уровни концентрации ряда цитокинов в эндометрии и сыворотке крови, в частности у-интерферона, фактора некроза опухоли а, интерлейкинов-1 и 2.
В настоящее время аллоиммунные факторы, ведущие к ранним потерям беременности, и пути коррекции указанных выше состояний находятся в стадии изучения. Нет единого мнения о методах терапии. По данным одних исследователей, активная иммунизация лимфоцитами донора не дает значимого эффекта, другие авторы описывают значимый положительный эффект при такой иммунизации и лечении иммуноглобулинами.
В настоящее время одним из иммуномодулирующих средств в ранние сроки беременности является прогестерон. В частности, в исследованиях доказана роль дидрогестерона в суточной дозе 20 мг у женщин с привычным выкидышем в I триместре беременности при повышенном уровне CD56-клеток в эндометрии.
 [11],
[12],
[13],
[14],
[15],
[16]
[11],
[12],
[13],
[14],
[15],
[16]
Генетически обусловленные тромбофилии
К тромбофилическим состояниям во время беременности, приводящим к привычному невынашиванию, относят следующие формы генетически обусловленных тромбофилий.
- Дефицит антитромбина III.
- Мутация фактора V (лейденовская мутация).
- Дефицит протеина С.
- Дефицит протеина S.
- Мутация гена протромбина G20210A.
- Гипергомоцистеинемия.
Обследование для выявления редких причин тромбофилии необходимо в случаях, если были:
- в семейном анамнезе - тромбоэмболии в возрасте до 40 лет у родственников;
- достоверные эпизоды венозных и/или артериальных тромбозов в возрасте до 40 лет;
- рецидивирующие тромбозы у больной и ближайших родственников;
- тромбоэмболические осложнения при беременности и после родов при использовании гормональной контрацепции;
- повторные потери беременности, мертворождения, задержка внутриутробного развития плода, отслойки плаценты;
- раннее начало преэклампсии, HELLP-синдром.
Инфекционные причины привычного невынашивания беременности
Роль инфекционного фактора как причины привычного выкидыша в настоящее время широко дискутируется. Известно, что при первичном инфицировании на ранних сроках беременности возможны несовместимые с жизнью повреждения эмбриона, что ведет к спорадическому самопроизвольному выкидышу. Однако вероятность реактивации инфекции в тот же срок с исходом в повторные потери беременности ничтожно мала. Кроме того, в настоящее время не найдены микроорганизмы, провоцирующие привычный выкидыш. Исследования последних лет показали, что у большинства женщин с привычным выкидышем и наличием хронического эндометрита отмечают превалирование в эндометрии 2–3 и более видов облигатно-анаэробных микроорганизмов и вирусов.
По данным В.М. Сидельниковой и соавт., у женщин, страдающих привычным невынашиванием, вне беременности диагноз хронического эндометрита гистологически верифицирован в 73,1% случаев и в 86,7% наблюдали персистенцию условно-патогенных микроорганизмов в эндометрии, что, безусловно, может служить причиной активации иммунопатологических процессов. Смешанную персистентную вирусную инфекцию (вирус простого герпеса, Коксаки А, Коксаки В, энтеровирусы 68–71, цитомегаловирус) встречают у больных с привычным выкидышем достоверно чаще, чем у женщин с нормальным акушерским анамнезом. К. Kohut и соавт. (1997) показали, что процент воспалительных изменений в эндометрии и децидуальной ткани у больных с первичным привычным невынашиванием беременности достоверно выше, чем у женщин после выкидыша с наличием в анамнезе как минимум одних своевременных родов.
Бактериально-вирусная колонизация эндометрия становится, как правило, следствием неспособности иммунной системы и неспецифических защитных сил организма (системы комплемента, фагоцитоза) полностью элиминировать инфекционный агент, и в то же время возникает ограничение его распространения за счет активации Т-лимфоцитов (Т-хелперов, естественных киллеров) и макрофагов. Во всех перечисленных выше случаях возникает персистенция микроорганизмов, характеризующаяся привлечением в очаг хронического воспаления мононуклеарных фагоцитов, естественных киллеров, Т-хелперов, синтезирующих различные цитокины. По-видимому, подобное состояние эндометрия препятствует созданию локальной иммуносупрессии в преимплантационный период, необходимой для формирования защитного барьера и предотвращения отторжения наполовину чужеродного плода.
В этой связи до беременности у женщин с привычным невынашиванием должен быть исключен диагноз хронического эндометрита. Для постановки или исключения этого диагноза используют биопсию эндометрия на 7–8-й день менструального цикла с проведением гистологического исследования, ПЦР и бактериологического исследования материала из полости матки. При верификации диагноза проводят лечение хронического эндометрита согласно стандартам лечения воспалительных заболеваний органов малого таза.

