Новые публикации
Мутация гена ARID1A делает опухоли чувствительными к иммунотерапии
Последняя редакция: 14.06.2024

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Иммунотерапия произвела революцию в лечении рака за последние годы. Вместо того чтобы непосредственно нацеливаться на опухоль, иммунотерапия направляет иммунную систему пациентов на более эффективную атаку опухолей. Это особенно эффективно для некоторых труднолечимых видов рака. Однако менее половины всех пациентов с раком реагируют на текущие иммунотерапии, что создает срочную необходимость в идентификации биомаркеров, которые могут предсказать, какие пациенты с наибольшей вероятностью получат пользу от лечения.
Недавно ученые заметили, что пациенты, у которых в опухолях есть мутация гена ARID1A, с большей вероятностью положительно реагируют на блокаду иммунных контрольных точек, тип иммунотерапии, который работает, удерживая иммунные клетки, борющиеся с раком, в активированном состоянии.
Поскольку мутация гена ARID1A присутствует во многих видах рака, включая эндометриальный, овариальный, колоректальный, желудочный, печеночный и панкреатический рак, исследователи из Института Солка задались вопросом, как она может способствовать чувствительности к лечению и как клиницисты могут использовать эту информацию для персонализации лечения рака для каждого пациента.
Их новое исследование, опубликованное в журнале Cell показывает, что мутация ARID1A делает опухоли чувствительными к иммунотерапии, привлекая в опухоль иммунные клетки, борющиеся с раком, через иммуноответ, подобный противовирусному.
Исследователи предполагают, что эта мутация и противовирусный иммуноответ могут быть использованы как биомаркер для лучшего выбора пациентов для специфических иммунотерапий, таких как блокада иммунных контрольных точек. Эти результаты также поощряют разработку лекарств, нацеленных на ARID1A и связанные с ним белки, чтобы сделать другие опухоли более чувствительными к иммунотерапии.
"Это может действительно изменить результаты лечения рака у пациентов," говорит доцент Диана Харгривз, старший автор исследования. "Пациенты с мутацией ARID1A уже имеют иммунный ответ, поэтому все, что нам нужно сделать, это усилить этот ответ с помощью блокады иммунных контрольных точек, чтобы помочь им уничтожить свои опухоли изнутри."
Хотя было известно, что люди с мутациями ARID1A хорошо реагируют на блокаду иммунных контрольных точек, точная связь между ними оставалась неясной. Чтобы прояснить механизм этого процесса, ученые из Института Солка использовали мышиные модели меланомы и колоректального рака с мутацией ARID1A и функциональным ARID1A.
Источник: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Команда наблюдала мощный иммунный ответ во всех моделях с мутацией ARID1A, но не в тех, где ARID1A был функциональным, что поддерживает идею, что мутация ARID1A действительно является движущей силой этого ответа. Но как это работает на молекулярном уровне?
"Мы обнаружили, что ARID1A играет важную роль в ядре, поддерживая правильную организацию ДНК," говорит Мэттью Максвелл, первый автор исследования и аспирант лаборатории Харгривз. "Без функционального ARID1A свободная ДНК может быть вырезана и выброшена в цитозоль, что активирует желательный противовирусный иммунный ответ, который можно усилить с помощью блокада иммунных контрольных точек."
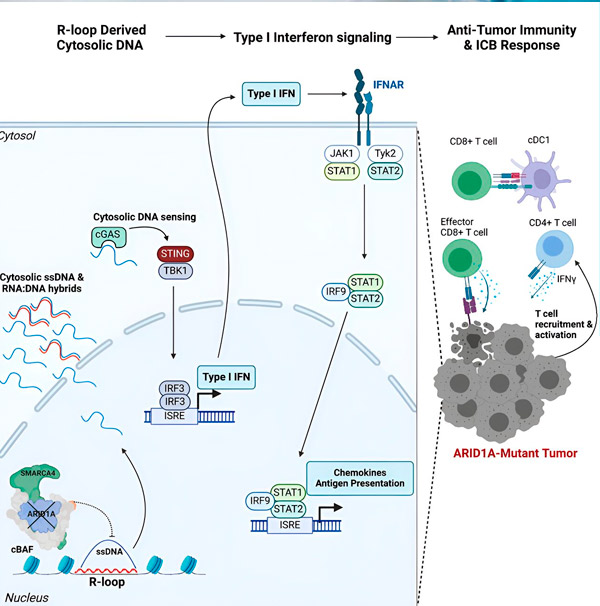
Ген ARID1A кодирует белок, который помогает регулировать форму нашей ДНК и поддерживать стабильность генома. Когда ARID1A мутирует, в раковых клетках запускается цепочка событий, аналогичная машине Руба Голдберга.
Сначала отсутствие функционального ARID1A приводит к выходу ДНК в цитозоль. Затем цитозольная ДНК активирует противовирусную систему тревоги — путь cGAS-STING, поскольку наши клетки адаптированы к тому, чтобы отмечать любую ДНК в цитозоле как чужеродную для защиты от вирусных инфекций. В конечном итоге путь cGAS-STING привлекает иммунную систему к рекрутированию Т-клеток в опухоль и активирует их в специализированные Т-клетки-убийцы рака.
На каждом этапе, зависящем от предыдущего, эта цепочка событий — мутация ARID1A, выход ДНК, тревога cGAS-STING, рекрутирование Т-клеток — приводит к увеличению числа борющихся с раком Т-клеток в опухоли. Блокада иммунных контрольных точек может затем использоваться для обеспечения того, чтобы эти Т-клетки оставались активированными, что усиливает их способность побеждать рак.
"Наши результаты предоставляют новый молекулярный механизм, с помощью которого мутация ARID1A может способствовать противоопухолевому иммунному ответу," говорит Харгривз. "Самое захватывающее в этих результатах — их переводной потенциал. Мы можем использовать мутации ARID1A для выбора пациентов для блокада иммунных контрольных точек, и теперь мы видим механизм, с помощью которого препараты, ингибирующие ARID1A или его белковый комплекс, могут быть использованы для дальнейшего усиления иммунотерапии у других пациентов."
Описывая механизм, с помощью которого блокада иммунных контрольных точек более эффективна для раков с мутацией ARID1A, исследователи предоставили клиницистам основания для приоритизации этой иммунотерапии для пациентов с мутацией ARID1A. Эти результаты являются важным шагом в персонализации лечения рака и вдохновляют на разработку новых терапий, нацеленных на ингибирование ARID1A и его белкового комплекса.
В будущем команда из Института Солка надеется, что их выводы улучшат результаты лечения пациентов с различными типами рака, связанными с мутациями ARID1A, и намерена исследовать этот клинический перевод в сотрудничестве с Калифорнийским университетом в Сан-Диего.
