Новые публикации
Учёные обнаружили новый иммуносупрессивный механизм при раке мозга
Последняя редакция: 14.06.2024

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Доцент Филиппо Веглия, Ph.D., и его команда из Института Уистар обнаружили ключевой механизм, с помощью которого глиобластома — серьезный и часто смертельный рак мозга — подавляет иммунную систему, чтобы опухоль могла расти, не встречая сопротивления со стороны защитных механизмов организма.
Их открытие было опубликовано в статье "Glucose-driven histone lactylation promotes the immunosuppressive activity of monocyte-derived macrophages in glioblastoma" в журнале Immunity.
"Наше исследование показывает, что механизмы самосохранения рака, при достаточном понимании, могут быть использованы против болезни очень эффективно," сказал д-р Веглия.
"Я с нетерпением жду будущих исследований механизмов иммуносупрессии, обусловленных метаболизмом, при глиобластоме и надеюсь, что мы продолжим узнавать больше о том, как лучше понять и бороться с этим раком."
До сих пор было мало изучено, как моноцитопроизводные макрофаги и микроглия создают иммуносупрессивную опухолевую микроокружающую среду при глиобластоме.
Лаборатория Веглия исследовала клеточные механизмы иммуносупрессии при глиобластоме и выявила, что по мере прогрессирования глиобластомы моноцитопроизводные макрофаги начинают численно превосходить микроглию, что указывает на то, что преобладание моноцитопроизводных макрофагов в опухолевой микроокружающей среде выгодно для рака в плане уклонения от иммунного ответа.
Действительно, моноцитопроизводные макрофаги, но не микроглия, блокировали активность Т-клеток (иммунных клеток, уничтожающих опухолевые клетки) в доклинических моделях и у пациентов. Команда подтвердила это, оценив доклинические модели глиобластомы с искусственно уменьшенным количеством моноцитопроизводных макрофагов.
Как и ожидалось, модели с меньшим количеством злокачественных макрофагов в опухолевой микроокружающей среде показали улучшенные результаты по сравнению со стандартными моделями глиобластомы.
Глиобластома составляет чуть более половины всех злокачественных опухолей, возникающих в мозге, и прогноз для пациентов, у которых диагностирована эта болезнь, крайне неблагоприятен: только 25% пациентов переживают первый год после постановки диагноза. Глиобластома опасна не только из-за своего расположения в мозге, но и из-за иммуносупрессивной опухолевой микроокружающей среды, которая делает глиобластому устойчивой к перспективным иммунотерапиям.
Программируя определенные иммунные клетки, такие как макрофаги (моноцитопроизводные макрофаги и микроглия), работать на опухоль, а не против нее, глиобластома создает для себя опухолевую микроокружающую среду, которая позволяет раку агрессивно расти, уклоняясь от антираковых иммунных реакций.
Выяснение механизма
Подтвердив роль моноцитопроизводных макрофагов, лаборатория Веглия затем попыталась понять, как именно эти связанные с раком иммунные клетки работают против иммунной системы.
Они секвенировали макрофаги, чтобы определить, имеют ли клетки какие-либо аномальные схемы экспрессии генов, которые могли бы указать на гены, играющие роль в иммуносупрессии, и также исследовали метаболические схемы макрофагов, чтобы понять, связана ли аномальная экспрессия генов с метаболизмом.
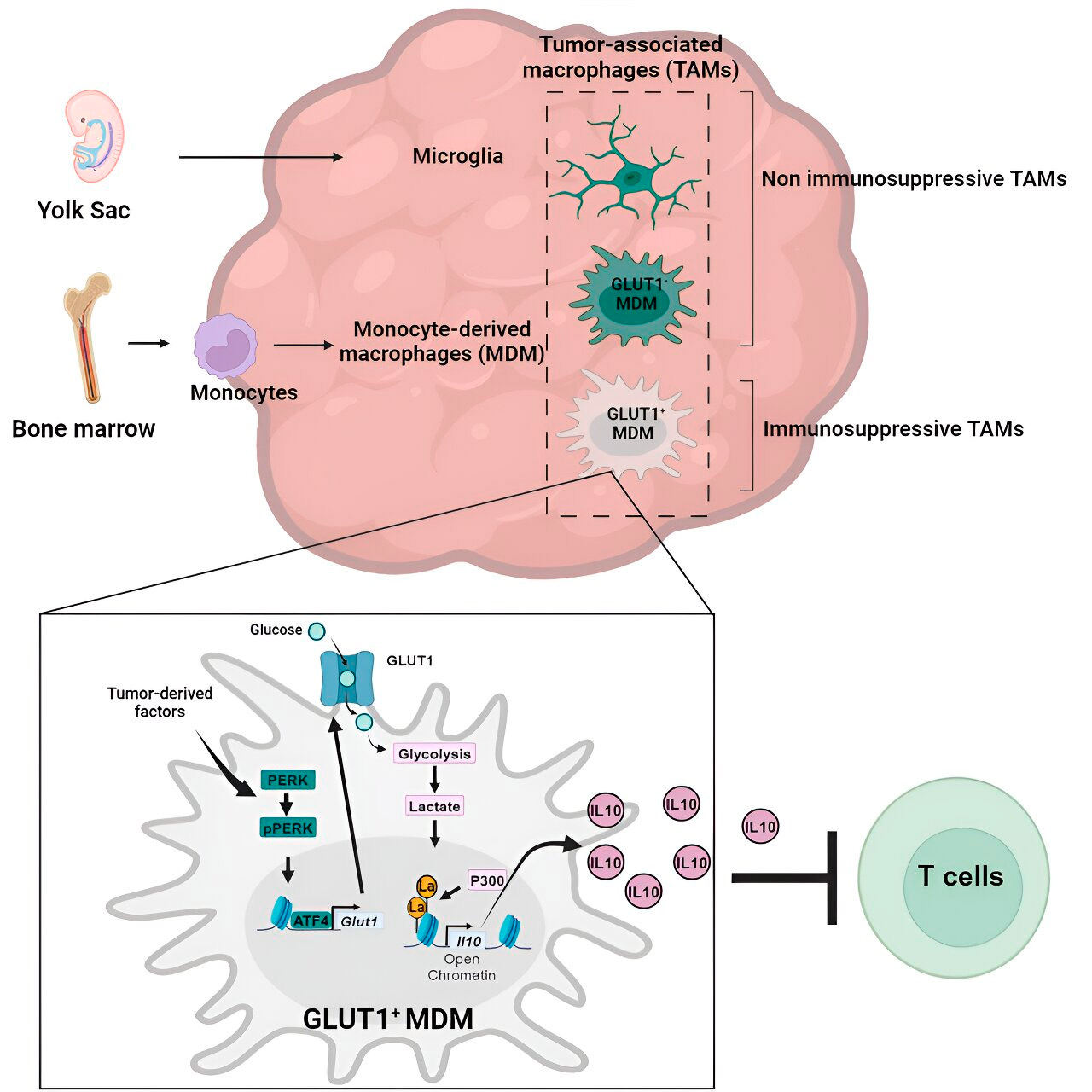
Анализ генов и метаболизма привел их к метаболизму глюкозы. Серия тестов показала, что моноцитопроизводные макрофаги с повышенным метаболизмом глюкозы и экспрессией GLUT1, основного транспортера для глюкозы, блокировали функцию Т-клеток, высвобождая интерлейкин-10 (IL-10).
Команда продемонстрировала, что глиобластома нарушает метаболизм глюкозы в этих макрофагах, вызывая их иммуносупрессивную активность.
Гистоновое лактилирование и его роль
Исследователи обнаружили, что ключ к иммуносупрессивной активности моноцитопроизводных макрофагов, связанной с метаболизмом глюкозы, заключается в процессе, называемом "гистонное лактилирование". Гистоны — это структурные белки в геноме, которые играют ключевую роль в экспрессии генов, таких как IL-10, в определенных контекстах.
Быстро метаболизируя глюкозу, моноцитопроизводные макрофаги производят лактат, побочный продукт метаболизма глюкозы. Гистоны могут становиться "лактилированными" (то есть лактат интегрируется в гистоны) таким образом, что организация гистонов способствует экспрессии IL-10, который продуцируется моноцитопроизводными макрофагами для поддержки роста раковых клеток.
Решение проблемы
Но как можно остановить иммуносупрессивную активность моноцитопроизводных макрофагов, связанную с метаболизмом глюкозы? Д-р Веглия и его команда выявили возможное решение: PERK, фермент, который они идентифицировали как регулятор метаболизма глюкозы и экспрессии GLUT1 в макрофагах.
В доклинических моделях глиобластомы таргетинг PERK нарушал гистонное лактилирование и иммуносупрессивную активность макрофагов, а в сочетании с иммунотерапией блокировал прогрессию глиобластомы и индуцировал долговременный иммунитет, защищающий мозг от повторного роста опухоли, что свидетельствует о том, что таргетинг оси PERK-гистонное лактилирование может быть жизнеспособной стратегией борьбы с этим смертельным раком мозга.
