Медицинский эксперт статьи
Новые публикации
Бешенство у детей
Последняя редакция: 04.07.2025

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Бешенство (rabies), или водобоязнь (hydrophobia), - острое вирусное заболевание, передающееся через укусы инфицированного животного, с поражением нервной системы и развитием тяжёлого энцефалита с летальным исходом.
Код по МКБ-10
Эпидемиология
Вирус бешенства, с древних времен являвшийся бедствием для общественного здравоохранения, в настоящее время является причиной примерно 59 000 смертей людей в год, почти все из которых передаются через укусы собак. Это оказывает значительное экономическое воздействие на развивающиеся страны, в первую очередь в Африке и Азии, которые в наименьшей степени могут нести такие убытки. Однако, несмотря на почти 100% летальность, собачье бешенство является полностью предотвратимым заболеванием, и исторические примеры искоренения собачьего бешенства в развитом мире свидетельствуют об этом. [1]
Причины бешенства
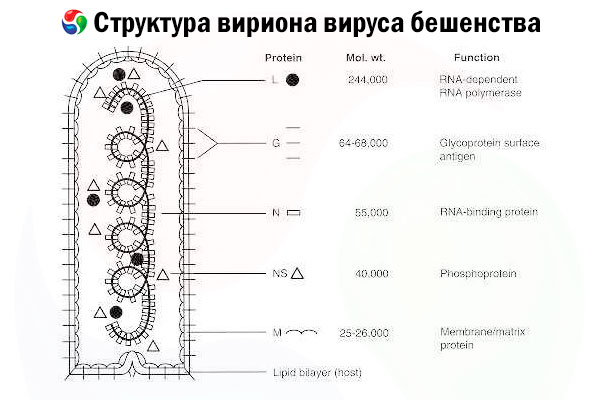
Возбудителем является вирус бешенства (rabies virus, RV), РНК-вирус с отрицательной цепью из семейства рабдовирусов, размером приблизительно 60 нм × 180 нм.
Он состоит из внутреннего белкового ядра или нуклеокапсида, содержащего нуклеиновую кислоту, и внешней оболочки, липид-содержащего бислоя, покрытого шипами трансмембранного гликопротеина. Имеет относительно простую модульную структуру генома и кодирует пять структурных белков:
- РНК-зависимую РНК-полимеразу (L),
- нуклеопротеин (N ),
- фосфорилированный белок (P),
- матричный белок (M) и
- гликопротеин внешней поверхности (G).
Белки N, P и L вместе с геномной РНК образуют рибонуклеопротеидный комплекс. G - единственный антиген RV, способный индуцировать продукцию нейтрализующих RV антител, которые являются основными иммунными эффекторами против летальной инфекции RV. С другой стороны, было показано, что комплекс рибонуклеопротеидный комплекс является основным антигеном RV, способным индуцировать CD4 +.Т-клетки, которые могут увеличивать выработку RV-нейтрализующих антител за счет внутриструктурного распознавания антигена. [2] Рибонуклеопротеидный комплекс может играть важную роль в установлении иммунологической памяти и длительного иммунитета. [3]
Классификация и антигенные типы
Род Lyssavirus включает вирус бешенства и антигенные и генетически связанные вирусы бешенства: вирусы летучих мышей Лагоса (Lagos), Мокола (Mokola) и Duvenhage, а также два предполагаемых подтипа лиссавирусов европейских летучих мышей. Исследования перекрестной защиты показывают, что животные, иммунизированные традиционными вакцинами против бешенства, могут не быть полностью защищены при заражении другими лиссавирусами.
Вирусы бешенства можно разделить на фиксированные (адаптированные путем пассажа на животных или культуре клеток) или уличные (дикий тип). Использование моноклональных антител и генетического секвенирования для дифференциации вирусов уличного бешенства помогло в выявлении вирусных вариантов, происходящих из основных резервуаров хозяев по всему миру, и в предположении вероятных источников воздействия на человека, когда история окончательного укуса животного в другом случае отсутствовала в случае пациента. [8]
Патогенез
Основным резервуаром и источником инфекции среди диких животных служат волки, лисицы, шакалы, летучие мыши, а среди домашних животных - собаки и кошки, редко - лошади, крупный рогатый скот, свиньи, крысы и др. Передача инфекции от человека человеку хотя и возможна, но бывает крайне редко. Это типичная зоонозная инфекция. Человек заражается бешенством главным образом от собак.
После укуса человека больным животным вирус размножается в мышечной ткани в месте укуса, а затем, достигнув окончаний чувствительных периферических нервов, распространяется центростремительно, достигая двигательных нейронов. Время продвижения вируса и поражения мозга зависят от места укуса. При тяжёлых укусах головы и лица вирус может достигать ЦНС за 15-20 сут, а при незначительных повреждениях кожных покровов туловища и конечностей и, следовательно, малой дозе возбудителя процесс продвижения вируса к ЦНС может задержаться на несколько месяцев или даже до 1-1,5 лет. Достигая ЦНС, вирус фиксируется в тканях головного и спинного мозга, преимущественно в нейронах продолговатого мозга, аммоновом роге, основании мозга. В спинном мозге более всего поражаются задние рога. Из ЦНС вирус центробежно по нервным стволам достигает слюнных желёз, где размножается и выделяется со слюной.
Понятия в патогенезе бешенства
RV имеет широкий круг хозяев и может инфицировать почти всех млекопитающих. Хотя сообщалось о нескольких путях передачи RV, естественное заражение чаще всего происходит через укус. Помимо укусов, потребление инфицированных RV тушек может способствовать инфицированию вируса бешенства у песцов, и было обнаружено, что контакт RV со слизистыми оболочками является еще одним возможным путем передачи. [9] В некоторых необычных обстоятельствах, таких как случайный выброс RV в виде аэрозоля в лаборатории или RV в виде аэрозоля в пещерах, населенных большим количеством летучих мышей, [10] может происходить передача через аэрозоль.
Пока не ясно, реплицируются ли уличные RV и адаптированные к мышам или адаптированные к культуре ткани штаммы RV в месте инокуляции до того, как они проникнут в ЦНС. В то время как экспериментальное внутримышечное заражение молодых хомяков или енотов уличным RV выявило репликацию RV в поперечнополосатых мышечных клетках до того, как вирус вторгся в аксоны мотонейронов через нервно-мышечные соединения, [11], [12] внутримышечное инфицирование мышей адаптированным к мышам CVS-24 RV показали, что RV мигрирует непосредственно в ЦНС без предварительной репликации в месте инокуляции. [13] После попадания в терминалы немиелинизированных аксонов RV ретроградно транспортируется к телу клетки.
Недавние открытия показывают, что транспорт аксональных пузырьков может представлять собой ключевую стратегию перемещения вирионов на большие расстояния в аксонах. [14] Было подсчитано, что RV мигрирует внутри аксонов со скоростью 3 мм / ч. [15] Затем инфекция распространяется через цепочку нейронов, соединенных синаптическими соединениями. Однако точный механизм, который способствует транссинаптическому распространению, все еще неизвестен. После заражения головного мозга вирус центробежно распространяется к периферической и вегетативной нервной системе во многих периферических органах. [16] На последней стадии инфекционного цикла RV мигрирует в слюнные железы; после репликации в мукогенных ацинарных клетках он попадает в слюну и готов к передаче следующему хозяину. [17]
Что касается патологии, вызванной вирусом бешенства, апоптотическая гибель клеток была предложена в качестве потенциального патогенного механизма в экспериментальных моделях бешенства мышей, инфицированных фиксированным штаммом RV. [18] Патогенным механизмом, который может способствовать глубокой дисфункции ЦНС, характерной для бешенства, может быть нарушение функций нейронов. Было показано, что экспрессия генов заметно снижена в нейронах, инфицированных RV, что приводит к общему подавлению синтеза белка, [19] а несколько исследований показали нарушение нейротрансмиссии после инфицирования RV. Цзян продемонстрировал, что связывание антагониста ацетилхолинового рецептора с инфицированными гомогенатами головного мозга крысы было снижено по сравнению с контролем. [20] В мозге крысы, инфицированной RV, также наблюдалось нарушение как высвобождения, так и связывания серотонина, нейромедиатора, участвующего в контроле цикла сна, восприятия боли и поведения. [21], [22] Помимо воздействия на нейротрансмиссию, инфекция правого желудочка может также влиять на ионные каналы. Инфицированные клетки нейробластомы мыши демонстрируют снижение функциональной экспрессии потенциал-зависимых натриевых каналов, что может предотвращать потенциалы действия и в конечном итоге приводить к функциональным нарушениям. [23]
В дополнение к отсутствию серьезных патологических поражений в ЦНС, в большинстве случаев человеческого бешенства через 7–10 дней после появления клинических признаков иммунный ответ не выявляется. Эти глубокие различия между патогенезом бешенства и патогенеза большинства других вирусных или бактериальных инфекций ЦНС дополнительно подтверждаются тем фактом, что иммуносупрессия либо не имеет эффекта, либо пагубно сказывается на исходе бешенства. [24] Низкий уровень иммунного ответа, часто наблюдаемый у жертв бешенства, вызывает недоумение, поскольку его нельзя объяснить слабой иммуногенностью антигенов RV. Фактически, RV G и белок нуклеокапсида являются мощными B- и T-клеточными антигенами при парентеральном введении. [25] Возможное объяснение низкой степени иммунного ответа против RV у людей или животных, страдающих бешенством, может заключаться в том, что RV-инфекция ЦНС вызывает иммуносупрессию, [26] и было предложено, что RV использует подрывную стратегию, включая предотвращение апоптоза и разрушение вторгающихся Т-клеток. [27]
Аттенуированные штаммы RV, которые были адаптированы к ненейрональным клеткам, значительно отличаются от патогенных штаммов уличных RV по их нейроинвазивности, которая относится к их способности проникать в ЦНС из периферических участков. В этом отношении адаптированные к культуре ткани штаммы RV либо не обладают, либо имеют лишь ограниченную способность вторгаться в ЦНС из периферических участков, тогда как штаммы уличных RV или адаптированные к мышам штаммы RV, такие как CVS-24, являются высокоинвазивными. [28] Ключевыми факторами, вовлеченными в нейроинвазию RV, являются захват вируса, аксональный транспорт, транс-синаптическое распространение и скорость репликации вируса.
До недавнего времени наши знания о патогенезе RV были ограниченными и в основном основывались на описательных исследованиях уличных штаммов RV или экспериментальном заражении ослабленными штаммами, адаптированными в лаборатории. Появление технологии обратной генетики позволило идентифицировать вирусные элементы, которые определяют патогенный фенотип RV, и лучше понять механизмы, участвующие в патогенезе бешенства.
Идентификация вирусных элементов, контролирующих захват, распространение и репликацию вируса бешенства
- Вирусные элементы, участвующие в захвате вируса
Инфекция RV начинается с прикрепления вируса к предполагаемому клеточному рецептору. Хотя несколько молекул мембранной поверхности были предложены в качестве рецепторов RV, включая никотиновый ацетилхолиновый рецептор, [29] молекулу адгезии нервных клеток [30] и низкоаффинный рецептор нейротропина p75 NTR, [31] до сих пор не ясно, действительно ли эти молекулы играют роль роль в жизненном цикле вируса бешенства. В этом контексте недавно было показано, что взаимодействие RV G – p75 NTR не является необходимым для инфицирования RV первичных нейронов. [32] После связывания с рецептором RV интернализуется посредством адсорбционного или рецепторно-опосредованного эндоцитоза. [33] Затем среда с низким pH внутри эндосомного компартмента вызывает конформационные изменения в RV G, которые запускают слияние вирусной мембраны с эндосомальной мембраной, тем самым высвобождая RNP в цитоплазму. [34] Что касается вирусов, RV G играет решающую роль в захвате вируса, скорее всего, через взаимодействие с предполагаемыми клеточными рецепторами, которые способствуют быстрому захвату. В этом отношении было продемонстрировано, что патогенность адаптированных к культуре ткани штаммов RV (например, ERA, HEP и CVS-11) коррелирует с наличием детерминанты, расположенной в антигенном сайте III G-белка. [35] Мутация Arg → Gln в положении 333 в этом антигенном сайте белка G ERA привела к семикратной задержке интернализации варианта Gln333 RV по сравнению с вариантом дикого типа. Мутация Asn 194 → Lys 194 в RV G, которая объясняет повторное появление патогенного фенотипа, была связана со значительным уменьшением времени интернализации. [36] Кроме того, эксперименты с химерными RV показали, что время, необходимое для интернализации вирионов RV, значительно увеличилось, а патогенность сильно снизилась после замены гена G высокопатогенного штамма SB RV, который был получен из клона кДНК, полученного из серебра. штамм RV-18, ассоциированный с летучими мышами, [37] с таковым из сильно аттенуированного штамма SN, который был выделен из клона кДНК вакцинного штамма SAD B19 RV. [38] Вместе эти данные подтверждают мнение о том, что кинетика поглощения вируса, которая является функцией G RV, является основным фактором, определяющим патогенность RV.
- Вирусные элементы, участвующие в распространении и переносе вирусов
Уникальным свойством вируса бешенства является его способность распространяться от клетки к клетке. Наблюдение за тем, что вариант Gln333 ERA теряет pH-зависимую активность слияния клеток in vitro [39] и демонстрирует сильно сниженную способность распространяться от клетки к клетке, [40] предполагает, что G RV также играет ключевую роль в распространение от клетки к клетке и, следовательно, перенос вируса, вероятно, за счет его фузиогенной активности. Эта возможность дополнительно подтверждается обнаружением того факта, что скорость распространения патогенного ревертанта RV SPBNGAK почти в два раза выше, чем определенная для непатогенного варианта SPBNGA. Интересно, что Asn 194 → Lys 194Мутация в G SPBNGAK вызывала сдвиг порога pH для слияния мембран в сторону более высокого pH, подтверждая гипотезу о том, что более высокий порог pH для слияния мембран связан с увеличением распространения вируса. [41]
Исследования транснейрональных индикаторов инфекции RV у крыс [42] и макак-резусов [43] показали, что вирус бешенства мигрирует исключительно в ретроградном направлении в аксонах. Хотя некоторые белки RV вовлечены в механизмы нейронального транспорта, G RV, по-видимому, играет преобладающую роль в транснейрональном распространении инфекции RV. Например, в то время как периферическое инфицирование вирусом инфекционной анемии лошадей (EIAV), псевдотипированным RV G, приводит к переносу вируса в спинной мозг, тот же EIAV, псевдотипированный вирусом G везикулярного стоматита, не смог проникнуть в нервную систему. [44] Кроме того, обнаружено, что вирусное распространение ERA G Arg 333 → Gln 333мутант в ЦНС сильно редуцирован по сравнению с мутантом дикого типа, также указывает на функцию интактного RV G в транс-синаптическом распространении. Однако наиболее убедительные доказательства важной роли RV G в транс-синаптическом транспорте получены от внутричерепной инфекции мышей рекомбинантным вирусом с дефицитом G RV, что показало, что инфекция оставалась ограниченной нейронами в месте инокуляции без каких-либо признаков заражения. распространяется на вторичные нейроны. [45] Однако вполне вероятно, что в дополнение к RV G, RV M также играет роль в распространении вируса и, следовательно, в транссинаптическом транспорте. В этом отношении было показано, что распространение химерного варианта SN-BMBG RV, который содержит как M, так и G из высокопатогенного SB, было значительно выше, чем распространение химерного варианта SN-BG или SN-BM, которые содержат G и M из SB, соответственно, предполагая, что оптимальное взаимодействие M с G может играть важную роль в распространении вируса от клетки к клетке. [46] Поскольку RV M поддерживает почкование вируса, [47] вероятно, что более эффективное распространение химерного варианта RV SN-BMBG обусловлено оптимальным почкованием вируса на постсинаптической мембране.
Недавние исследования показали, что взаимодействие между RV P и легкой цепью dynein связывает RNP RV с транспортной системой клетки-хозяина, тем самым облегчая ретроградный транспорт аксонального вируса. [48], [49] Однако периферическое инфицирование взрослых мышей показало, что удаление связывающего домена LC8 из RV P не предотвращает проникновение вируса в ЦНС, что позволяет предположить, что белок RV не принимает непосредственного участия в ретроградном аксональном распространении RV. [50]
- Вирусные элементы, контролирующие репликацию вируса
В отличие от многих других вирусов, таких как вирус гриппа, патогенность RV обратно пропорциональна скорости синтеза вирусной РНК и продукции инфекционных вирусных частиц. Сравнение уровней вирусной мРНК и геномной РНК, продуцируемой различными химерными вирусами, предполагает, что транскрипция и репликация вирусной РНК регулируются несколькими факторами, включая RV M, который был идентифицирован как транс-действующий фактор, который опосредует переключение с начальных высоких уровней От синтеза мРНК до синтеза геномной РНК. [51] Более того, M всех рабдовирусов способен отключать экспрессию вирусных генов путем связывания с RNP, что приводит к образованию сильно конденсированной скелетоподобной структуры, которая неспособна поддерживать синтез РНК.
Для идентификации других вирусных элементов, которые контролируют патогенность путем регулирования репликации вируса, 5'-концевые последовательности высокопатогенного штамма SB были поэтапно заменены последовательностями сильно аттенуированного вакцинного штамма SN, в результате чего были получены рекомбинантные вирусы SB2 (концевая последовательность [ TS] + L), SB3 (TS + L + псевдоген [Ψ]), SB4 (TS + L + Ψ + G) и SB5 (TS + L + Ψ + G + M). Внутримышечная инфекция родительскими вирусами SB и SN и химерными RV SB2, SB3, SB4 и SB5 выявила самые высокие уровни смертности у мышей, инфицированных SB, и отсутствие заболеваемости или смертности у мышей, инфицированных SN. Замена TS, L и в SB соответствующими элементами из SN привела к умеренному снижению заболеваемости и смертности, а дополнительный обмен G или G плюс M сильно снизил или полностью исключил патогенность вируса.
Фенотипическая характеристика этих дикого типа и химерных RV в культуре ткани показала, что патогенность конкретного RV обратно коррелирует с его способностью реплицироваться в нейрональных клетках. Хотя SB реплицировался на уровнях почти в 1000 раз ниже, чем SN, а замена TS, L и в SB на уровни SN мало влияла на кинетику роста вируса, дополнительная замена G или G плюс M SB соответствующими генами SN привела к 1-логарифмическому увеличению продукции вируса, предполагая, что кинетика репликации вирусной РНК, а также продукция вирусных частиц в значительной степени контролируются RV. Белок G. Этот вывод подтверждается данными, полученными с вариантами G RV, которые отличаются одной аминокислотой в их G-белках. Патогенный вариант вируса бешенства SPBNGAK 194 продуцировал титр вируса в клетках NA, который был на 1 логарифм ниже, чем титр, продуцируемый непатогенным вариантом SPBNGAN 194, и анализ ПЦР в реальном времени показал, что скорость транскрипции и репликации вирусной РНК в инфицированных клетках NA с SPBNGAK в 5 и 10 раз выше, чем в клетках NA, инфицированных SPBNGAK. [52] Дополнительные доказательства обратной корреляции между патогенностью и скоростью синтеза вирусной РНК и продукции вирусных частиц были получены от мышей, инфицированных химерными рекомбинантными вирусами, у которых гены G и M аттенуированного штамма SN были заменены на гены высокопатогенного штамма SB. Эти эксперименты выявили значительное повышение патогенности родительского штамма SN, несущего RV G, от патогенного штамма SB. Патогенность еще больше увеличивалась, когда и G, и M из SB были введены в SN.
Замена G или M или обоих в SN соответствующими генами из SB была связана со значительным снижением скорости продукции вирусных частиц, а также скорости синтеза вирусной РНК. Эти данные показывают, что как G, так и M играют важную роль в патогенезе RV, регулируя репликацию вируса. Обнаружение того, что замена G или G плюс M в SN на G или G плюс M SB приводит к умеренному или сильному снижению транскрипции и репликации вирусной РНК, соответственно, в то время как замена только M в SN на SB M приводит к в сильном увеличении транскрипции и репликации вирусной РНК, это указывает на то, что RV G также выполняет важную регуляторную функцию в транскрипции / репликации вирусной РНК либо отдельно, либо через взаимодействие с белком М. Механизм, с помощью которого ген RV G контролирует синтез вирусной РНК, неизвестен. Определенные нуклеотидные последовательности в генах RV G, такие как те, которые включают кодоны для Arg333 и Lys 194 были идентифицированы как мишени для клеточных miRNA. Было показано, что распознавание мишени клеточными miRNA может приводить к положительной или отрицательной регуляции репликации вируса. [53] Замены Arg 333 → Glu 333 или Lys 194 → Ser 194 в последовательности гена RV G приводит к отмене целевых последовательностей для miRNA, что, в свою очередь, связано со значительным увеличением скорости синтеза вирусной РНК [Faber M, Thomas Jefferson University, PA, USA, Unpublished Data], что позволяет предположить, что хозяин клеточные miRNA также играют важную роль в регуляции репликации RV, как это было показано для других РНК-вирусов, включая вирус везикулярного стоматита и HCV. [54], [55]
Регуляция вирусной репликации, по-видимому, является одним из важных механизмов, участвующих в патогенезе RV. Чтобы избежать иммунного ответа и сохранить целостность нейронной сети, патогенные штаммы RV, но не аттенуированные штаммы, могут регулировать скорость своего роста. Более низкий уровень репликации, вероятно, приносит пользу патогенным штаммам RV, сохраняя структуру нейронов, которые используются этими вирусами для достижения ЦНС. Другое объяснение более низкой скорости репликации патогенных RV заключается в том, что для того, чтобы избежать раннего обнаружения иммунной системой хозяина, вирус поддерживает минимальные уровни экспрессии своих антигенов.
Связь между экспрессией G RV, апоптозом и патогенностью
Хорошо известно, что штаммы уличных вирусов бешенства, которые являются значительно более патогенными, чем штаммы, адаптированные к культуре тканей, экспрессируют очень ограниченные уровни G и не вызывают апоптоз до конца инфекционного цикла, что позволяет предположить, что патогенность конкретного штамма вируса имеет обратную корреляцию. с экспрессией RV G и способностью вызывать апоптоз. [56] Прямые доказательства корреляции между уровнем экспрессии G и степенью апоптоза были получены с рекомбинантным RV SPBNGA-GA, который нес два идентичных G-гена и сверхэкспрессировал RV G. [57] Морфологические исследования культур нейронов, инфицированных этим рекомбинантным RV, показали, что гибель клеток значительно увеличивалась параллельно со сверхэкспрессией G RV и что апоптоз является основным механизмом, участвующим в G-опосредованной гибели RV. В частности, снижение окрашивания F-актина после заражения SPBNGA-GA согласуется с вызванной апоптозом деполимеризацией актиновых филаментов. Кроме того, количество TUNEL-положительных ядер в нейронах, инфицированных SPBNGA-GA, значительно увеличилось по сравнению с количеством в неинфицированных и инфицированных SPBNGA нейронах. Однако механизм, с помощью которого ген RV G опосредует процесс передачи сигналов апоптоза, остается в значительной степени неизвестным. Было высказано предположение, что экспрессия RV G, превышающая определенный порог, серьезно нарушает клеточную мембрану. Весьма вероятно, что апоптотические клетки не очищаются быстро в ЦНС и поэтому подвергаются вторичному некрозу. [58] С другой стороны, инфекция RV и, в частности, сверхэкспрессия G-белка RV может привести к пироптозу, пути гибели клеток, подобному апоптозу, который, в отличие от апоптоза, включает активацию каспазы 1 и тем самым приводит к некрозу. [59] Степень некроза или пироптоза, вызванного инфекцией правого желудочка, вероятно, играет решающую роль в индукции противовирусного иммунитета. В то время как апоптотические клетки поддерживают целостность своей мембраны и не стимулируют врожденный иммунный ответ, некротические клетки становятся проницаемыми и выделяют эндогенные адъюванты, которые могут запускать устойчивый врожденный иммунный ответ. [60]
Поскольку уровень апоптоза / некроза коррелирует с иммуногенностью RV, было высказано предположение, что иммуностимулирующий эффект апоптотических / некротических клеток, скорее всего, способствует генерации защитного иммунного ответа. Следовательно, регуляция экспрессии RV G очень вероятно является важным фактором в патогенезе бешенства, поскольку она обеспечивает средства для выживания и распространения патогенных вариантов RV в нервной системе, не вызывая явного повреждения нейронов и вызывая защитный иммунный ответ, который помешает заражению.
Экспрессия RV G может регулироваться на уровне синтеза РНК, посттрансляционном уровне или на обоих уровнях. Было показано, что уровни RV G, экспрессируемые различными химерными вариантами RV, отражаются скоростью синтеза вирусной РНК, что указывает на то, что дифференциальная регуляция экспрессии RV G этими вариантами является результатом вариаций в скорости транскрипции вирусного вируса. мРНК. Как и в случае скорости транскрипции вирусной РНК, количество RV G, экспрессируемое этими вариантами, обратно коррелирует с патогенностью вируса. С другой стороны, инфицирование первичных культур нейронов менее патогенным вариантом RV CVS-B2c привело к четырехкратному повышению уровня G-белка, чем инфицирование высокопатогенным вариантом CVS-N2c, несмотря на синтез сопоставимых уровней G-мРНК при обеих инфекциях. Эксперименты Pulse-chase показали, что более высокие уровни G-белка в нейронах, инфицированных CVS-B2c, были в значительной степени результатом более низкой скорости деградации G-белка CVS-B2c по сравнению с G-белком CVS-N2c. Однако механизм, который приводит к более быстрой протеолитической деградации белка CVS-N2c G, требует выяснения.
Симптомы бешенства
Инкубационный период при бешенстве в среднем 30-90 дней. При массивном инфицировании через обширные раны головы и лица он может укорачиваться до 12 сут. В редких случаях инкубационный период может длиться 1 год и более.
Происходит строго последовательная смена трёх периодов заболевания: продромального, возбуждения,параличей.
Продромальный период начинается с появления на месте укуса ноющих или тянущих болей, а также болей по ходу нервов. В области рубца возможны ощущения жжения, зуда, иногда появляются краснота и отёчность. Больной испытывает общее недомогание, головную боль, тошноту. Отмечают рвоту, повышение температуры тела до 37,5-38 °С и симптомы прогрессирующего нарушения психического статуса: повышенную рефлекторную возбудимость, необъяснимое чувство тревоги, страха, тоски. Часто больной подавлен, заторможен, замкнут, отказывается от еды, плохо спит, жалуется на мрачные мысли, устрашающие сновидения. Продромальный период длится 2-3 дня, иногда удлиняется до 7 сут. В конце этого периода могут быть приступы беспокойства с кратковременными затруднениями дыхания, чувством стеснения в груди, сопровождающиеся тахикардией и учащением дыхания.
Период возбуждения знаменуется появлением гидрофобии: при попытке пить, а затем и при виде воды или напоминании о ней у больного появляется судорожный спазм глотки и гортани, во время которого он с криком отбрасывает кружку с водой, выбрасывает вперёд дрожащие руки, запрокидывает назад голову и туловище. Шея при этом вытягивается, мучительная гримаса искажает лицо, которое становится синюшным вследствие спазма дыхательной мускулатуры. Глаза выпячиваются, выражают испуг, молят о помощи, зрачки расширены, вдох затруднён. На высоте приступа возможна остановка сердца и дыхания. Приступ длится несколько секунд, после чего состояние больного как бы улучшается. В дальнейшем приступы судорог мышц гортани и глотки могут возникать даже от движения воздуха (аэрофобия), яркого света (фотофобия) или громкого слова (акустикофобия). Приступы сопровождаются психомоторным возбуждением, во время которого больной ведёт себя как «бешеный». Сознание в момент приступа помрачено, но в межприступном периоде проясняется. В периоде возбуждения вследствие повышенного тонуса симпатической нервной системы у больных резко повышается саливация (сиалорея) с невозможностью проглотить слюну вследствие спазма мышц глотки. Больной брызжет слюной. У некоторых больных могут появляться признаки менингизма и даже опистотонус, нередко бывают судороги. При этом спинномозговая жидкость может не меняться, но у некоторых больных возможно повышение концентрации белка и увеличение числа клеток за счёт лимфоцитов.
Без адекватного лечения нарастают признаки обезвоживания, черты лица заостряются, масса тела снижается. Температура тела повышается до высоких значений. Возможны судороги. Продолжительность стадии возбуждения - около 2-3 сут, редко - 4-5 сут. Во время одного из приступов обычно наступает летальный исход. Изредка больной доживает до третьей стадии болезни.
В периоде параличей больной успокаивается. Прекращаются приступы гидрофобии, больной может пить и глотать пищу, сознание ясное. Однако, несмотря на кажущееся благополучие, нарастают вялость, апатия, депрессия, вскоре появляются параличи конечностей, расстройство тазовых органов, параличи черепных нервов. Температура тела повышается до 42-43 °С, артериальное давление падает, и к концу первых суток наступает смерть от паралича сердечно-сосудистого и дыхательного центров.
В периферической крови отмечают нейтрофильный лейкоцитоз, повышение гемоглобина, эритроцитов, гематокрита.
Что беспокоит?
Формы
Клинически различают типичные и атипичные формы. К атипичным относят все случаи без возбуждения и гидрофобии. Среди атипичных различают бульбарные, мозжечковые, менингоэнцефалитические и др.
Диагностика бешенства
Обнаружение антигена бешенства, антител, вирусной РНК или выделение вируса позволяет поставить диагноз бешенства. Поскольку любой индивидуальный тест может быть отрицательным у пациента с бешенством, иногда необходимы серийные образцы сыворотки для выявления антител к бешенству, образцы слюны для культивирования вируса и биопсия кожи для прямого иммунофлюоресцентного тестирования на вирусный антиген, особенно при наличии сильного подозрения на бешенство..
Один из самых быстрых методов диагностики прижизненного бешенства у людей - это проведение прямого иммунофлюоресцентного теста на биопсии кожи на затылке шеи для выявления антигена бешенства. Прямой иммунофлюоресцентный тест является наиболее чувствительным и специфическим методом обнаружения антигена бешенства в коже и других свежих тканях (например, биопсия головного мозга), хотя результаты могут иногда быть отрицательными на ранних стадиях заболевания. Если свежая ткань недоступна, ферментное переваривание фиксированных тканей может повысить реактивность иммунофлуоресцентного теста; однако чувствительность может быть неприемлемо низкой.
Диагноз также может быть установлен, если вирус выделен из слюны после инокуляции клеток нейробластомы или лабораторных грызунов; Обычно это наиболее эффективно в течение первых 2–3 недель болезни. Обнаружение антител, нейтрализующих вирус бешенства, которое обычно выполняется с помощью теста быстрого подавления флюоресцентного фокуса (RFFIT), в сыворотке невакцинированных лиц также является диагностическим. Присутствие антител в спинномозговой жидкости подтверждает диагноз, но они могут появиться на 2-3 дня позже, чем антитела в сыворотке, и поэтому могут быть менее полезными на ранних стадиях заболевания. В то время как серологический ответ после вакцинации в целом невозможно отличить от серологического ответа, вызванного заболеванием, вакцинация обычно не дает антител к спинномозговой жидкости.
Только семь случаев «выздоровления» от бешенства за последние 25 лет хорошо задокументированы. Хотя вирус бешенства не был выделен ни у одного из пациентов, высокий титр нейтрализующих бешенство антител в образцах сыворотки и присутствие нейтрализующих антител в спинномозговой жидкости убедительно подтвердили диагноз.
Что нужно обследовать?
Какие анализы необходимы?
Дифференциальная диагностика
Диагноз человеческого бешенства обычно подтверждается эпидемиологическими и клиническими данными и подтверждается в лаборатории. Диагноз не составляет труда, если в анамнезе есть случаи укусов животных и проявился полный спектр симптомов и признаков. В противном случае перед проведением специальных лабораторных исследований необходима тщательная, но быстрая оценка эпидемиологических и клинических особенностей менее типичных случаев. Каждого пациента с неврологическими признаками или симптомами или необъяснимым энцефалитом следует расспросить о возможности заражения животных в эндемичных по бешенству районах внутри или за пределами страны проживания. Невозможность заподозрить бешенство в нескольких недавних человеческих смертельных случаях в Соединенных Штатах могла произойти из-за отсутствия тщательного изучения истории заражения.
В начале болезни бешенство может имитировать многие инфекционные и неинфекционные заболевания. Многие другие энцефалиты, например, вызванные герпесвирусами и арбовирусами, напоминают бешенство. Другие инфекционные заболевания также могут напоминать бешенство, например столбняк, церебральная малярия, риккетсиоз и брюшной тиф. Паралитические инфекционные заболевания, которые можно спутать с бешенством, включают полиомиелит, ботулизм и энцефалит обезьяньего герпеса типа B.
Неинфекционные заболевания, которые можно спутать с бешенством, включают ряд неврологических синдромов, особенно острую воспалительную полинейропатию (синдром Гийена-Барре), а также аллергический поствакцинальный энцефаломиелит, вторичный по отношению к вакцинации против бешенства нервной ткани, интоксикации ядами или лекарствами, отказ от алкоголь, острая порфирия и истерия от бешенства. Синдром Гийена-Барре можно принять за паралитическую форму бешенства, и наоборот.
К кому обратиться?
Лечение бешенства
Лечение бешенства не разработано. Введение больших доз специфического антирабического иммуноглобулина и лейкоцитарного интерферона малоэффективно. Проводят симптоматическое лечение для облегчения страданий больного. С этой целью больного помещают в отдельную палату или бокс, создают охранительный режим, ограничивающий влияние внешней среды (уменьшение шума, яркого света, потоков воздуха). Для снижения возбудимости центральной нервной системы назначают снотворные, противосудорожные, болеутоляющие средства. Нормализуют водный баланс.
В паралитической стадии назначают средства, стимулирующие деятельность сердечно-сосудистой и дыхательной систем. Рекомендуют использовать гипербарическую оксигенацию, церебральную гипотермию, управляемое аппаратное дыхание с полной кураризацией больного. Однако все методы лечения оказываются практически неэффективными. В лучшем случае удаётся продлить жизнь больного на несколько месяцев. Неблагоприятный исход предрешён тяжестью поражения стволовой части мозга с разрушением жизненно важных центров.
Профилактика
С разработкой первой вакцины против бешенства Пастером в 1885 году началась эра гораздо более эффективных средств борьбы с бешенством. Сегодня, несмотря на почти 100%-ный уровень смертности людей от бешенства, болезнь можно полностью предотвратить с помощью вакцинации до и / или после контакта. В то время как Пастер и его коллеги инициировали вакцинацию частных собак в Париже, первая массовая вакцинация собак была проведена в начале 1920-х годов в Японии, что стало первой крупной национальной программой борьбы с бешенством. Оральная вакцинация диких животных, впервые разработанная в 1970-х годах, с тех пор неоднократно доказывала, что эффективно контролирует болезнь у основных наземных хозяев, таких как лисы, еноты и скунсы. [68] Устойчивая вакцинация от бешенства популяции животных-резервуаров при уровне охвата 70% или выше в конечном итоге устранит RABV из резервуарных видов и предотвратит распространение вируса на случайных хозяев. [69]
Филогенетические данные показывают, что лиссавирусы инфицировали летучих мышей задолго до того, как они заразили наземных млекопитающих, и большинство лиссавирусов, включая RABV, все еще циркулируют у различных видов летучих мышей по всему миру. [70] Однако эффективные методы предотвращения передачи RABV среди летучих мышей остаются труднодостижимыми, что исключает возможность полного искоренения бешенства в настоящее время. Однако даже после контакта с RABV в результате укуса инфицированного бешенством млекопитающего безопасная и эффективная профилактика после контакта (ПКП, включающая промывание ран, антирабический иммуноглобулин и вакцинация против бешенства) может защитить человека от заражения бешенством, если лечение проводится своевременно и в соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ).
Эти два метода предотвращения смерти людей - один основан на вакцинации людей, подвергшихся воздействию, а другой основан на вакцинации достаточного количества собак, чтобы разорвать цикл передачи в источнике - являются строительными блоками подхода «единого здоровья» к собакам. профилактика и контроль бешенства. Эти два разных средства предотвращения смерти людей рассматривались как отдельные альтернативы: стратегия A, основанная на предоставлении людям PEP, и стратегия B, основанная на вакцинации собак; или как компоненты комбинированной стратегии A + B при анализе вероятных затрат на альтернативные стратегии. [71]
Такие страны, как Таиланд, добились огромных успехов в предотвращении человеческих смертей за счет применения ПКП, но также обнаружили растущий спрос и связанные с этим затраты, связанные с использованием только ПКП. [72] Например, по сравнению с ситуацией 1991 года, в 2003 году ПКП требовалось в четыре раза больше людей (более 400 000 человек). Последние данные показывают, что Китайская Народная Республика, которая вакцинирует 15 миллионов человек в год после потенциального заражения бешенством, тратит около 650 миллионов долларов США в год только на ПКП. [73]
Гораздо более устойчивый подход состоит в том, чтобы предотвратить распространение инфекции у источника, в популяции животных, одновременно увеличивая доступ к ПКП для облученных пациентов-людей, когда это необходимо. Там, где есть политическая воля и адекватные финансы для борьбы с собачьим бешенством, смертельные случаи могут быть устранены и были устранены. Широкое применение вакцинации собак привело к ликвидации собачьего бешенства в нескольких странах, включая Малайзию в 1954 г., [74] в Японии в 1956 г., на Тайване в 1961 г., Сингапуре и, в частности, по всей Западной Европе (обзор в Rupprecht et al, King et al, и Гонгал и Райт). [75]
Использованная литература


 [
[