Медицинский эксперт статьи
Новые публикации
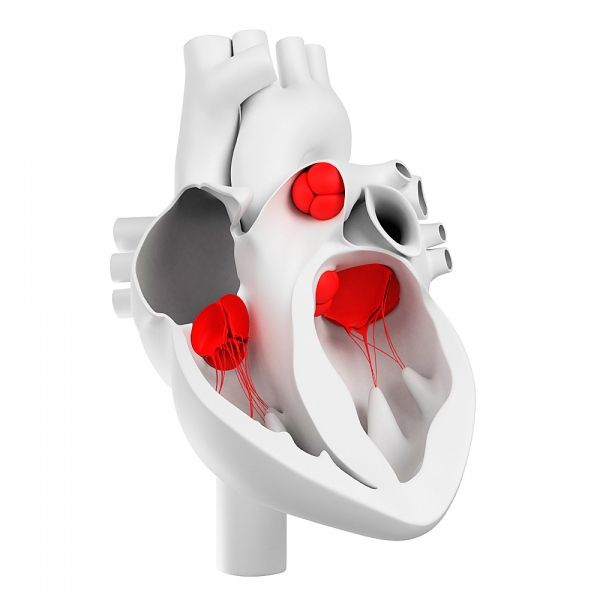
Сердечные клапаны
Последняя редакция: 23.04.2024

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Ранее считалось, что все сердечные клапаны - простые структуры, чей вклад в однонаправленное течение крови является просто пассивным движением в ответ на действующий градиент давления. Такое понимание «пассивных структур» привело к созданию «пассивных» механических и биологических заменителей клапанов.
Сейчас становится очевидным, что сердечные клапаны имеют более сложное строение и функцию. Поэтому создание «активного» заменителя клапана сердца предполагает значительную схожесть его по структуре и функции с естественным клапаном сердца, что в перспективе вполне реально благодаря развитию тканевой инженерии.
Сердечные клапаны развиваются из эмбриональных зачатков мезенхимальной ткани при закладке эндокарда. В процессе морфогенеза формируются предсердно-желудочковый канал (трикуспидальный и митральный cердечные клапаны) и желудочковый выносящий тракт (аортальный и пульмональный cердечные клапаны).
Как устроены сердечные клапаны?
Начало исследования кровоснабжения клапанов положил Н Luschka (1852), применив инъекцию сосудов сердца контрастной массой. Он обнаружил в створках предсердно-желудочковых и полулунных клапанов аорты и легочной артерии многочисленные кровеносные сосуды. Вместе с тем, в ряде руководств по патологической анатомии и гистологии имелись указания о том, что неизмененные сердечные клапаны человека не содержат кровеносных сосудов, а последние появляются в клапанах только при различных патологических процессах - атеросклерозе и эндокардитах различной этиологии. Сведения об отсутствии кровеносных сосудов базировались в основном, на гистологических исследованиях. Предполагалось, что при отсутствии кровеносных сосудов в свободной части створок их питание происходит путем фильтрации жидкости из плазмы крови, омывающей створки. Отмечалось проникновение немногочисленных сосудов вместе с волокнами поперечнополосатой мышечной ткани в основания створок и сухожильных хорд.
Однако при инъекции сосудов сердца различными красителями (туши в желатине, висмута в желатине, водной взвеси черной туши, растворов кармина или трипанового голубого) было установлено, что сосуды проникают в предсердно-желудочковые cердечные клапаны, клапаны аорты и легочной артерии вместе с сердечной мышечной тканью, немного не достигая свободного края створки.
В рыхлой волокнистой соединительной ткани створок предсердно-желудочковых клапанов были обнаружены отдельные магистральные сосуды, анастомозирующие с сосудами рядом расположенных участков сердечной поперечнополосатой мышечной ткани.
Наибольшее количество кровеносных сосудов располагалось в основании и сравнительно меньшее - в свободной части этих клапанов.
По данным К. И. Кульчицкого и др. (1990), больший диаметр артериальных и венозных сосудов встречается в митральном клапане. В основании створок этого клапана располагаются, главным образом, магистральные сосуды с узкопетлистой сетью капилляров, проникающие в базальную часть створки и занимающие 10% ее площади. В трикуспидальном клапане артериальные сосуды имеют меньший диаметр, чем в митральном. В створках этого клапана располагаются, преимущественно, сосуды рассыпного типа и сравнительно широкие петли кровеносных капилляров. В митральном клапане более интенсивно кровоснабжается передняя створка, в трикуспидальном - передняя и задняя створки, несущие основную замыкательную функцию. Соотношение диаметров артериальных и венозных сосудов в предсердно-желудочковых клапанах сердца людей зрелого возраста составляет 1:1,5. Петли капилляров имеют полигональную форму и располагаются перпендикулярно основанию створок клапана. Сосуды образуют плоскостную сеть, расположенную под эндотелием со стороны предсердий. Кровеносные сосуды выявлены также в сухожильных хордах, куда они проникают из сосочковых мышц правого и левого желудочков на расстояние до 30% длины сухожильных хорд. Многочисленные кровеносные сосуды образуют дугообразные петли в основании сухожильных хорд. Сердечные клапаны аорты и легочного ствола по кровоснабжению в значительной степени отличаются от предсердно-желудочковых. К основанию полулунных створок клапанов аорты и легочного ствола подходят магистральные сосуды относительно меньшего диаметра. Короткие ветви этих сосудов заканчиваются петлями капилляров неправильной овальной и полигональной формы. Они располагаются, преимущественно, вблизи основания полулунных створок. Венозные сосуды в основании клапанов аорты и легочной артерии также имеют меньший диаметр, чем в основании предсердно-желудочковых клапанов. Соотношение диаметров артериальных и венозных сосудов в клапанах аорты и легочной артерии сердца людей зрелого возраста составляет 1:1,4. От более крупных сосудов отходят короткие боковые веточки, заканчивающиеся петлями капилляров неправильной овальной и полигональной формы.

С возрастом наблюдается огрубление волокон соединительной ткани, как коллагеновых, так и эластических, а также уменьшение количества рыхлой волокнистой неоформленной соединительной ткани, развивается склероз ткани створок предсердно-желудочковых клапанов и полулунных створок клапанов аорты и легочной артерии. Уменьшается протяженность в клапанах волокон сердечной поперечнополосатой мышечной ткани, а следовательно, снижается ее количество и число проникающих в сердечные клапаны кровеносных сосудов. В связи с указанными изменениями cердечные клапаны теряют свои эластические и упругие свойства, что оказывает влияние на механизм закрытия створок и гемодинамику.
Сердечные клапаны имеют сети лимфатических капилляров и незначительное количество лимфатических сосудов, снабженных клапанами. Лимфатические капилляры створок имеют характерный вид: просвет их весьма неравномерен, один и тот же капилляр в разных участках имеет различный диаметр. В местах слияния нескольких капилляров образуются расширения - лакуны различной формы. Петли сетей имеют чаще неправильную многоугольную, реже овальную или круглую форму. Нередко петли лимфатических сетей не замкнуты, и лимфатические капилляры заканчиваются слепо Петли лимфатических капилляров ориентированы чаще в направлении от свободного края створки к ее основанию. В ряде случаев в створках атриовентрикулярного клапана была обнаружена двухслойная сеть лимфатических капилляров.
Нервные сплетения эндокарда располагаются в различных его слоях, главным образом под эндотелием. У свободного края створок клапанов нервные волокна располагаются, преимущественно, радиально, соединяясь с таковыми сухожильных хорд. Ближе к основанию створок образуется крупнопетлистое нервное сплетение, которое соединяется со сплетением, находящимся вокруг фиброзных колец. На полулунных створках эндокардиальная нервная сеть более редкая. У места прикрепления клапанов она становится густой и многослойной.
Клеточное строение сердечных клапанов
Клапанные интерстициальные клетки, отвечающие за поддержание структуры клапана, имеют вытянутую форму с большим числом тонких отростков, которые тянутся через весь матрикс клапана. Существуют две популяции клапанных интерстициальных клеток, отличающихся по морфологии и структуре; одни обладают сократительными свойствами и характеризуются наличием сократительных фибрилл другие обладают секреторными свойствами и имеют хорошо развитый эндоплазматический ретикулум и аппарат Гольджи. Сократительная функция противостоит гемодинамическому давлению и дополнительно поддерживается выработкой как кардиального, так и скелетного сократительных белков, которые включают тяжелые цепи альфа- и бета-миозина и различные изоформы тропонина. Сокращение створки сердечного клапана было продемонстрировано в ответ на ряд вазоактивных агентов, предполагающих координирующее действие биологического стимула для успешного функционирования клапана.
Интерстициальные клетки являются также необходимыми компонентами восстановительной системы таких структур, как сердечные клапаны. Постоянное движение створок и деформация соединительной ткани, связанная с ней, производит повреждение, на которое клапанные интерстициальные клетки реагируют с целью сохранения целостности клапана. Восстановительный процесс оказывается жизненно важным для нормального функционирования клапана, и отсутствие этих клеток в современных моделях искусственных клапанов, вероятно, является фактором, способствующим структурным повреждениям биопротезов.
Важным направлением в исследовании интерстициапьных клеток является изучение взаимодействия между ними и окружающим их матриксом, опосредованное фокальной адгезией молекул. Фокальные адгезии - специализированные клеточно-матриксные участки взаимодействия, связывающие цитоскелет клетки с белками матрикса через интегрины. Они также действуют как сигнальные участки для трансдукции, передающие механическую информацию с внеклеточного матрикса, которая может добиваться ответов, включая, но не ограничиваясь этим, клеточную адгезию, миграцию, рост и дифференциацию. Понимание клеточной биологии клапанных интерстициальных клеток жизненно важно для установления механизмов, при помощи которых эти клетки взаимодействуют между собой и окружающей средой, для возможности воспроизведения этой функции в искусственных клапанах.
В связи с развитием перспективного направления тканевой инженерии сердечных клапанов исследования интерстициапьных клеток проводятся с использованием широкого спектра методик. Наличие цитоскелета клеток подтверждено окрашиванием на виментин, десмин, тропонин, альфа-актина и миозина гладких мышц, тяжелых цепей альфа- и бета-миозина, легких цепей-2 кардиального миозина, альфа- и бета-тубулина. Сокращаемость клеток подтверждена позитивным ответом на епинефрин, ангиотензин II, брадикинин, карбахол, хлорид калия, эндотелии I. Клеточная взаимосвязь определена функциональными щелевыми взаимодействиями и проверена микроинъекциями карбоксифлюоресцеина. Матриксная секреция установлена окрашиванием на пролил-4-гидроксилазу / коллаген II типа, фибронектин, хондроитин сульфат, ламинин. Иннервация установлена близким расположением двигательных нервных окончаний, что отражается активностью нейропептида Y тирозин гидроксилазы, ацетилхолинэстеразы, вазоактивного кишечного полипептида, субстанции-Р, капьцитонин ген-связанного пептида. Митогенные факторы оценены тромбоцитарным-наследуемым фактором роста, основным фактором роста фибробластов, серотонином (5-НТ). Исследованные фибробласты интерстициальных клеток характеризуются неполной базальной мембраной, длинными, тонкими цитоплазматическими отростками, близкой связью с матриксом, хорошо развитым неровным эндоплазматическим ретикулумом и аппаратом Гольджи, богатством микрофиламентами, формированием адгезивных связей.
Клапанные эндокардиальные клетки формируют функциональную атромбогенную оболочку вокруг каждого клапана сердца, схожую с эндотелием сосудов. Широко используемый способ замены клапана ликвидирует защитную функцию эндокарда, что может приводить к отложению тромбоцитов и фибрина на искусственных клапанах, развитию бактериальной инфекции и кальцификации ткани. Другая вероятная функция этих клеток - регуляция нижележащих клапанных интерстициальных клеток, похожая на регуляцию гладкомышечных клеток эндотелием. Комплексное взаимодействие существует между эндотелием и соседними клетками, частично опосредованное растворимыми факторами, секретируемыми клетками эндотелия. Эти клетки образуют огромную поверхность, покрытую микровыростами на люминальнои стороне, таким образом увеличивается экспозиция и возможное взаимодействие с метаболическими субстанциями циркулирующей крови.
Эндотелий часто отображает морфологические и функциональные различия, вызванные сдвиговыми напряжениями на стенке сосуда, возникающими при движении крови, это же относится и к клапанным эндокардиальным клеткам, принимающих как вытянутую, так и полигональную форму. Изменения в структуре клетки могут происходить благодаря действию местной гемодинамики на компоненты цитоскелета клетки или вторичного эффекта, вызванного изменениями в нижележащем внеклеточном матриксе. На уровне ультраструктуры клапанные эндокардиальные клетки обладают межклеточными связями, плазматическими пузырьками, неровным эндоплазматическим ретикулумом и аппаратом Гольджи. Несмотря на то, что они вырабатывают фактор Виллебранда, как в живом организме, так и в искусственной среде, в них отсутствуют тельца Вейбель-Палада (специфические гранулы, содержащие фактор Виллебранда), которые являются органеллами, характерными для эндотелия сосудов. Клапанные эндокардиальные клетки характеризуются прочными соединениями, функциональными щелевыми взаимодействиями и перекрываются краевыми складками.
Эндокардиальные клетки сохраняют свою метаболическую активность даже in vitro: вырабатывают фактор Виллебранда, простациклин, синтазу оксида азота, демонстрируют активность ангиотензин превращающего фермента, усиленно выделяют молекулы адгезии ICAM-1 и ELAM-1, которые важны для связывания мононуклеарных клеток при развитии иммунного ответа. Все эти маркеры должны учитываться при выращивании идеальной культуры клеток для создания искусственного клапана методом тканевой инженерии, но иммуностимулирующий потенциал самих клапанных эндокардиальных клеток может ограничить их использование.
Внеклеточный метрикс сердечных клапанов состоит из волокнистых коллагеновых и эластиновых макромолекул, протеогликанов и гликопротеинов. Коллаген составляет - 60% сухого веса клапана, эластин - 10% и протеогликаны - 20%. Коллагеновый компонент обеспечивает основную механическую устойчивость клапана и представлен коллагенами I (74%). II (24%) и V (2%) типов. Пучки коллагеновых нитей окружены эластиновой оболочкой, которая осуществляет взаимодействие между ними. Гликозаминогликановые боковые цепи молекул протеогликана имеют тенденцию к формированию похожей на гель субстанции, в которой взаимодействуют другие молекулы матрикса для формирования постоянных взаимосвязей и откладываются другие компоненты. Гликозаминогликаны клапана сердца человека состоят, в основном, из гиалуроновой кислоты, в меньшей степени - из дерматан сульфата, хондроитин-4-сульфата и хондроитин-6-сульфата, с минимальным количеством гепаран сульфата. Ремоделирование и обновление ткани матрикса регулируются матриксными металлопротеиназами (ММП) и их тканевыми ингибиторами (ТИ). Эти молекулы также принимают участие в более широком спектре физиологических и патологических процессов Некоторые металлопротеиназы, включая интерстициальные коллагеназы (ММП-1, ММП-13) и желатиназы (ММП-2, ММП-9) и их тканевые ингибиторы (ТИ-1, ТИ-2, ТИ-3), обнаружены во всех клапанах сердца. Переизбыток выработки металлопротеиназ характерен для патологических состояний сердечного клапана.
 [6],
[7],
[8],
[9],
[10],
[11],
[12],
[13],
[14],
[15],
[16]
[6],
[7],
[8],
[9],
[10],
[11],
[12],
[13],
[14],
[15],
[16]
Сердечные клапаны и их морфологическое строение
Сердечные клапаны состоят из трех морфологически разных и функционально значимых слоев матрикса створки - фиброзного, губчатого и желудочкового.
Фиброзный слой формирует устойчивый к нагрузкам каркас створки клапана, состоящий из слоев коллагеновых волокон. Эти волокна располагаются радиально в виде складок для возможности растяжения артериальных клапанов при закрытии. Фиброзный слой лежит около выходной наружной поверхности этих клапанов. Фиброзный слои предсердно-желудочковых клапанов служит продолжением коллагеновых пучков сухожильных хорд. Он расположен между губчатым (входным) и желудочковым (выходным) слоями.
Между фиброзным и желудочковым находится губчатый слой (спонгиоза). Губчатый слой состоит из слабо организованной соединительной ткани в вязкой среде. Доминирующими матриксными компонентами этого слоя являются протеогликаны с произвольно ориентированным коллагеном и тонкими слоями эластина. Боковые цепи молекул протеогликанов несут сильный отрицательный заряд, что сказывается на их высокой способности связывать воду и формировать пористый гель матрикса. Губчатый слой матрикса снижает механические напряжения в створках сердечных клапанов и поддерживает их гибкость.
Желудочковый слой намного тоньше, чем другие, и изобилует эластичными волокнами, которые позволяют тканям противостоять постоянной деформации. Эластин имеет губчатую структуру, окружающую и соединяющую коллагеновые волокна, и обеспечивает поддержание их в нейтральном складчатом состоянии. Входной слой клапана (желудочковый - для артериальных клапанов и губчатый - для атриовентрикулярных) содержит большее количество эластина, чем выходной, что обеспечивает смягчение гидравлического удара при закрытии створок. Эта взаимосвязь между коллагеном и эластином допускает растяжение створок до 40% без устойчивой деформации. При воздействии малой нагрузки коллагеновые структуры этого слоя ориентируются в направлении нагружения, и сопротивление его к дальнейшему росту нагрузки возрастает.
Таким образом, представление о клапанах сердца как о простои дупликатуре эндокарда является не только упрощенным, но и, по существу, неверным. Сердечные клапаны - это орган со сложной структурой, включающий в себя поперечнополосатые мышечные волокна, кровеносные и лимфатические сосуды, нервные элементы. Как по своему строению, так и по функционированию клапаны составляют единое целое со всеми структурами сердца. Анализ нормальной функции клапана должен принимать во внимание его клеточную организацию, а также взаимодействие клеток между собой и матриксом. Знания, полученные в результате таких исследований, являются ведущими при проектировании и развитии протезирования клапанов с использованием тканевой инженерии.
Использованная литература

