Медицинский эксперт статьи
Новые публикации
Синтез, секреция и метаболизм катехоламинов
Последняя редакция: 19.10.2021

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Мозговой слой надпочечников продуцирует соединение далекой от стероидов структуры. Они содержат 3,4-диоксифенильное (катехоловое) ядро и называются катехоламинами. К ним относятся адреналин, норадреналин и дофамин бета-окситирамин.
Последовательность синтеза катехоламинов достаточно проста: тирозин → диоксифенилаланин (ДОФА) → дофамин → норадреналин → адреналин. Тирозин поступает в организм с пищей, но может и образовываться из фенилаланина в печени под действием фенилаланингидроксилазы. Конечные продукты превращения тирозина в тканях различны. В мозговом слое надпочечников процесс протекает до стадии образования адреналина, в окончаниях симпатических нервов - норадреналина, в некоторых нейронах центральной нервной системы синтез катехоламинов завершается образованием дофамина.
Превращение тирозина в ДОФА катализируется тирозингидроксилазой, кофакторами которой служат тетрагидро-биоптерин и кислород. Считается, что именно этот фермент лимитирует скорость всего процесса биосинтеза катехоламинов и ингибируется конечными продуктами процесса. Тирозингидроксилаза является главным объектом регуляторных воздействий на биосинтез катехоламинов.
Превращение ДОФА в дофамин катализируется ферментом ДОФА-декарбоксилазой (кофактор - пиридоксальфосфат), который относительно неспецифичен и декарбоксилирует и другие ароматические L-аминокислоты. Однако имеются указания на возможность модификации синтеза катехоламинов за счет изменения активности и этого фермента. В некоторых нейронах отсутствуют ферменты дальнейшего превращения дофамина, и именно он является конечным продуктом. Другие ткани содержат дофамин-бета-гидроксилазу (кофакторы - медь, аскорбиновая кислота и кислород), которая превращает дофамин в норадреналин. В мозговом слое надпочечников (но не в окончаниях симпатических нервов) присутствует фенилэтаноламин - метилтрансфераза, образующая из норадреналина адреналин. Донором метальных групп в этом случае служит S-аденозилметионин.
Важно помнить, что синтез фенилэтаноламин-N-Meтилтрансферазы индуцируется глюкокортикоидами, попадающими в мозговой слой из коркового по портальной венозной системе. В этом, возможно, и кроется объяснение факта объединения двух различных желез внутренней секреции в одном органе. Значение глюкокортикоидов для синтеза адреналина подчеркивается тем, что клетки мозгового слоя надпочечников, продуцирующие норадреналин, располагаются вокруг артериальных сосудов, тогда как адреналинпродуцирующие клетки получают кровь в основном из венозных синусов, локализованных в корковом слое надпочечников.
Распад катехоламинов протекает главным образом под влиянием двух ферментных систем: катехол-О-метилтрансферазы (КОМТ) и моноаминоксидазы (МАО). Главные пути распада адреналина и норадреналина схематически представлены на рис. 54. Под действием КОМТ в присутствии донора метиловых групп S-адренозилметионина катехоламины превращаются в норметанефрин и метанефрин (3-О-метил-производные норадреналина и адреналина), которые под влиянием МАО переходят в альдегиды и далее (в присутствии альдегидоксидазы) в ванилил-миндальную кислоту (ВМК) - основной продукт распада норадреналина и адреналина. В том же случае, когда катехоламины вначале подвергаются действию МАО, а не КОМТ, они превращаются в 3,4-диоксиминдалевый альдегид, а затем под влиянием альдегидоксидазы и КОМТ - в 3,4-диоксиминдальную кислоту и ВМК. В присутствии алкогольдегидрогеназы из катехоламинов может образовываться 3-метокси-4-оксифенилгликоль, являющийся основным конечным продуктом деградации адреналина и норадреналина в ЦНС.
Распад дофамина протекает аналогично, за тем исключением, что его метаболиты лишены гидроксильной группы у бета-углеродного атома, и поэтому вместо ванилил-миндальной кислоты образуется гомованилиновая (ГВК) или 3-метокси-4-оксифенилуксусная кислота.
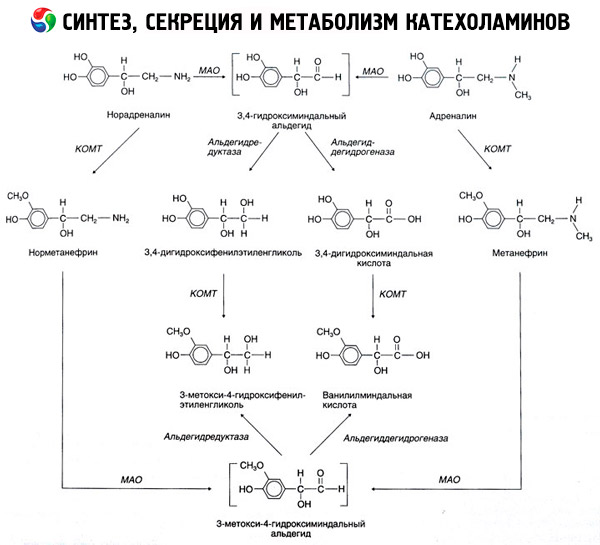
Постулируется также существование хиноидного пути окисления молекулы катехоламинов, на котором могут возникать промежуточные продукты, обладающие выраженной биологической активностью.
Образующиеся под действием цитозольных ферментов норадреналин и адреналин в окончаниях симпатических нервов и мозговом слое надпочечников поступают в секреторные гранулы, что предохраняет их от действия ферментов деградации. Захват катехоламинов гранулами требует энергетических затрат. В хромаффинных гранулах мозгового слоя надпочечников катехоламины прочно связаны с АТФ (в отношении 4:1) и специфическими белками - хромогранинами, что предотвращает диффузию гормонов из гранул в цитоплазму.
Непосредственным стимулом к секреции катехоламинов является, по-видимому, проникновение в клетку кальция, стимулирующего экзоцитоз (слияние мембраны гранул с клеточной поверхностью и их разрыв с полным выходом растворимого содержимого - катехоламинов, дофамин-бета-гидроксилазы, АТФ и хромогранинов - во внеклеточную жидкость).
Физиологические эффекты катехоламинов и механизм их действия
Эффекты катехоламинов начинаются с взаимодействия со специфическими рецепторами клеток-«мишеней». Если рецепторы тиреоидных и стероидных гормонов локализуются внутри клеток, то рецепторы катехоламинов (равно как и ацетилхолина и пептидных гормонов) присутствуют на наружной клеточной поверхности.
Уже давно было установлено, что в отношении одних реакций адреналин или норадреналин оказываются более эффективными, чем синтетический катехоламин изопротеренол, тогда как в отношении других эффект изопротеренола превосходит действия адреналина или норадреналина. На этом основании была разработана концепция о наличии в тканях двух типов адренорецепторов: альфа и бета, причем в отдельных из них может присутствовать только какой-либо один из этих двух типов. Изопротеренол является наиболее сильным агонистом бета-адренорецепторов, тогда как синтетическое соединение фенилефрин - наиболее сильным агонистом альфа-адренорецепторов. Природные катехоламины - адреналин и норадреналин - способны взаимодействовать с рецепторами обоих типов, однако адреналин проявляет большее сродство к бета-, а норадреналин - к альфа-рецепторам.
Катехоламины сильнее активируют сердечные бета-адренорецепторы, нежели бета-рецепторы гладких мышц, что позволило подразделить бета-тип на подтипы: бета1-рецепторы (сердце, жировые клетки) и бета2-рецепторы (бронхи, кровеносные сосуды и т. д.). Действие изопротеренола на бета1-рецепторы превосходит действие адреналина и норадреналина лишь в 10 раз, тогда как на бета2-рецепторы он действует в 100-1000 раз сильнее, чем природные катехоламины.
Применение специфических антагонистов (фентоламин и феноксибензамин в отношении альфа- и пропранолола в отношении бета-рецепторов) подтвердило адекватность классификации адренорецепторов. Дофамин способен взаимодействовать как с альфа-, так и с бета-рецепторами, но в различных тканях (мозг, гипофиз, сосуды) найдены и собственные дофаминергические рецепторы, специфическим блокатором которых является галоперидол. Количество бета-рецепторов колеблется от 1000 до 2000 на клетку. Биологические эффекты катехоламинов, опосредуемые бета-рецепторами, связаны, как правило, с активацией аденилатциклазы и повышением внутриклеточного содержания цАМФ. Рецептор и фермент хотя и соединены функционально, но представляют собой разные макромолекулы. В модуляции аденилатциклазной активности под влиянием гормон-рецепторного комплекса принимают участие гуанозинтрифосфат (ГТФ) и другие пуриновые нуклеотиды. Повышая активность фермента, они, по-видимому, снижают сродство бета-рецепторов к агонистам.
Давно известен феномен повышения чувствительности денервированных структур. Наоборот, длительное воздействие агонистов снижает чувствительность тканей-«мишеней». Изучение бета-рецепторов позволило объяснить эти явления. Показано, что длительное воздействие изопротеренола приводит к потере чувствительности аденилатциклазы за счет уменьшения числа бета-рецепторов.
Процесс десенситизации не требует активации синтеза белка и обусловлен, вероятно, постепенным образованием необратимых гормон-рецепторных комплексов. Напротив, введение 6-оксидофамина, разрушающего симпатические окончания, сопровождается увеличением числа реагирующих бета-рецепторов в тканях. Не исключено, что повышение симпатической нервной активности обусловливает и возрастную десенситизацию сосудов и жировой ткани по отношению к катехоламинам.
Число адренорецепторов в разных органах может контролироваться и другими гормонами. Так, эстрадиол увеличивает, а прогестерон уменьшает число альфа-адренорецепторов в матке, что сопровождается соответственным повышением и снижением ее сократительной реакции на катехоламины. Если внутриклеточным «вторым мессенджером», образующимся при действии агонистов бета-рецепторов, наверняка является цАМФ, то в отношении передатчика альфа-адренергических влияний дело обстоит сложнее. Предполагается существование различных механизмов: снижение уровня цАМФ, повышение содержания цАМФ, модуляция клеточной динамики кальция и др.
Для воспроизведения разнообразных эффектов в организме обычно требуются дозы адреналина, в 5-10 раз меньшие, чем норадреналина. Хотя последний является более эффективным в отношении а- и бета1-адренорецепторов, важно помнить, что оба эндогенных катехоламина способны взаимодействовать как с альфа-, так и с бета-рецепторами. Поэтому биологическая реакция данного органа на адренергическую активацию во многом зависит от типа присутствующих в нем рецепторов. Однако это не означает, что избирательная активация нервного или гуморального звена симпатико-адреналовой системы невозможна. В большинстве случаев наблюдается усиленная деятельность различных ее звеньев. Так, принято считать, что гипогликемия рефлекторно активирует именно мозговой слой надпочечников, тогда как снижение артериального давления (постуральная гипотензия) сопровождается в основном выбросом норадреналина из окончаний симпатических нервов.
Адренорецепторы и эффекты их активации в различных тканях
|
Система, орган |
Тип адрено-рецепторов |
Реакция |
|
Сердечно-сосудистая система: |
||
|
Сердце |
Бета |
Повышение частоты сокращений, проводимости и сократимости |
|
Артериолы: |
||
|
Кожи и слизистых оболочек |
Альфа |
Сокращение |
|
Скелетных мышц |
Бета |
Расширение Сокращение |
|
Органов брюшной полости |
Альфа (больше) |
Сокращение |
|
Бета |
Расширение |
|
|
Вены |
Альфа |
Сокращение |
|
Дыхательная система: |
||
|
Мышцы бронхов |
Бета |
Расширение |
|
Пищеварительная система: |
||
|
Желудок |
Бета |
Снижение моторики |
|
Кишечник |
Альфа |
Сокращение сфинктеров |
|
Селезенка |
Альфа |
Сокращение |
|
Бета |
Расслабление |
|
|
Внешнесекреторная часть поджелудочной железы |
Альфа |
Снижение секреции |
|
Мочеполовая система: |
Альфа |
Сокращение сфинктера |
|
Мочевой пузырь |
Бета |
Расслабление изгоняющей мышцы |
|
Мужские половые органы |
Альфа |
Эякуляция |
|
Глаза |
Альфа |
Расширение зрачка |
|
Кожа |
Альфа |
Повышение потоотделения |
|
Слюнные железы |
Альфа |
Выделение калия и воды |
|
Бета |
Секреция амилазы |
|
|
Эндокринные железы: |
||
|
Островки поджелудочной железы |
||
|
Бета-клетки |
Альфа (больше) |
Снижение секреции инсулина |
|
Бета |
Повышение секреции инсулина |
|
|
Альфа-клетки |
Бета |
Повышение секреции глюкагона |
|
8-клетки |
Бета |
Повышение секреции соматостатина |
|
Гипоталамус и гипофиз: |
||
|
Соматотрофы |
Альфа |
Повышение секреции СТГ |
|
Бета |
Снижение секреции СТГ |
|
|
Лактотрофы |
Альфа |
Снижение секреции пролактина |
|
Тиреотрофы |
Альфа |
Снижение секреции ТТГ |
|
Кортикотрофы |
Альфа |
Повышение секреции АКТГ |
| бета | Снижение секреции АКТГ | |
|
Щитовидная железа: |
||
|
Фолликулярные клетки |
Альфа |
Снижение секреции тироксина |
|
Бета |
Повышение секреции тироксина |
|
|
Парафолликулярные (К) клетки |
Бета |
Повышение секреции кальцитонина |
|
Околощитовидные железы |
Бета |
Повышение секреции ПТГ |
|
Почки |
Бета |
Повышение секреции ренина |
|
Желудок |
Бета |
Повышение секреции гастрина |
|
Основной обмен |
Бета |
Повышение потребления кислорода |
|
Печень |
? |
Повышение гликогенолиза и глюконеогенеза с выходш глюкозы; повышение кетогенеза с выходом кетоновых тел |
|
Жировая ткань |
Бета |
Повышение липолиза с выходом свободных жирных кислот и глицерина |
|
Скелетные мышцы |
Бета |
Повышение гликолиза с выходом пирувата и лактата; снижение протеолиза с уменьшением выхода аланина, глутамина |
Важно учитывать, что результаты внутривенного введения катехоламинов не всегда адекватно отражают эффекты эндогенных соединений. Это относится в основном к норадреналину, так как в организме он выделяется главным образом не в кровь, а непосредственно в синаптические щели. Поэтому эндогенный норадреналин активирует, например, не только сосудистые альфа-рецепторы (повышение артериального давления), но и бета-рецепторы сердца (учащение сердцебиений), тогда как введение норадреналина извне приводит преимущественно к активации сосудистых альфа-рецепторов и рефлекторному (через вагус) замедлению сердцебиений.
Низкие дозы адреналина активируют в основном бета-рецепторы мышечных сосудов и сердца, в результате чего падает периферическое сосудистое сопротивление и увеличивается минутный объем сердца. В некоторых случаях первый эффект может преобладать, и после введения адреналина развивается гипотензия. В более высоких дозах адреналин активирует и альфа-рецепторы, что сопровождается повышением периферического сосудистого сопротивления и на фоне роста минутного объема сердца приводит к повышению артериального давления. Однако сохраняется и его влияние на сосудистые бета-рецепторы. В результате прирост систолического давления превышает аналогичный показатель диастолического (увеличение пульсового давления). При введении еще больших доз начинают преобладать альфа-миметические эффекты адреналина: систолическое и диастолическое давление возрастают параллельно, как под влиянием норадреналина.
Воздействие катехоламинов на обмен веществ складывается из их прямых и опосредованных эффектов. Первые реализуются главным образом через бета-рецепторы. Более сложные процессы связаны с печенью. Хотя усиление печеночного гликогенолиза традиционно считается результатом активации бета-рецепторов, но имеются данные и об участии в этом альфа-рецепторов. Опосредованные эффекты катехоламинов связаны с модуляцией секреции многих других гормонов, например инсулина. В действии адреналина на его секрецию явно преобладает альфа-адренергический компонент, поскольку показано, что любой стресс сопровождается торможением инсулиновой секреции.
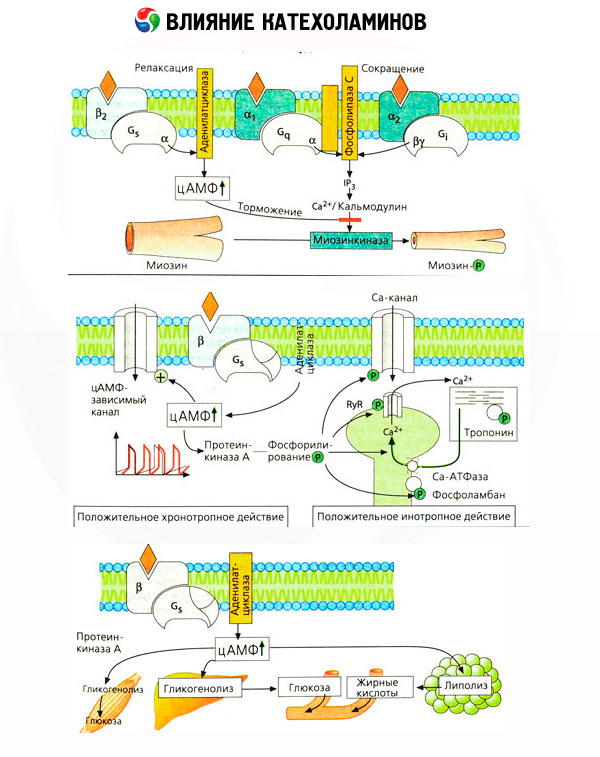
Сочетание прямых и опосредованных эффектов катехоламинов обусловливает гипергликемию, сопряженную не только с повышением печеночной продукции глюкозы, но и с торможением ее утилизации периферическими тканями. Ускорение липолиза вызывает гиперлипацидемию с повышенной доставкой жирных кислот в печень и интенсификацией продукции кетоновых тел. Усиление гликолиза в мышцах приводит к повышению выхода в кровь лактата и пирувата, которые вместе с глицерином, высвобождающимся из жировой ткани, служат предшественниками печеночного глюконеогенеза.
Регуляция секреции катехоламинов. Сходство продуктов и способов реагирования симпатической нервной системы и мозгового слоя надпочечников явилось основанием для объединения этих структур в единую симпатико-адреналовую систему организма с выделением нервного и гормонального ее звена. Различные афферентные сигналы концентрируются в гипоталамусе и центрах спинного и продолговатого мозга, откуда исходят эфферентные посылки, переключающиеся на клеточные тела преганглионарных нейронов, расположенных в боковых рогах спинного мозга на уровне VIII шейного - II-III поясничных сегментов.
Преганглионарные аксоны этих клеток покидают спинной мозг и образуют синаптические соединения с нейронами, локализующимися в ганглиях симпатической цепочки, или с клетками мозгового слоя надпочечников. Эти преганглионарные волокна являются холинергическими. Первое принципиальное отличие симпатических постганглионарных нейронов и хромаффинных клеток мозгового слоя надпочечников заключается в том, что последние передают поступающий к ним холинергический сигнал не нервно-проводниковым (постганглионарные адренергические нервы), а гуморальным путем, выделяя адренергические соединения в кровь. Второе различие сводится к тому, что постганглионарные нервы продуцируют норадреналин, тогда как клетки мозгового слоя надпочечников - преимущественно адреналин. Эти два вещества оказывают различное действие на ткани.

